题目内容
7.在相同温度时,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
分析 醋酸为弱电解质,溶液浓度越大,电离程度越小,以此解答该题.
解答 解:A.计算两溶液中醋酸的物质的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,两者相等,因而中和时消耗的NaOH的量相等,故A错误;
B.醋酸为弱电解质,溶液浓度越大,电离程度越小,电离程度前者大于后者,故B正确;
C.酸的浓度越大,c(H+)越大,前者小于后者,故C错误;
D.电离度与温度和浓度有关,当温度相同时,溶液的浓度越小,电离度越大,而两者的物质的量相等,所以H+的物质的量前者大于后者,故D正确.
故选BD.
点评 本题考查弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点.

练习册系列答案
相关题目
12.经测定,某集气瓶中只含N和O两种元素,下列说法不正确的是( )
| A. | 集气瓶中所含物质可能是纯净物 | |
| B. | 集气瓶中可能只含有两种单质 | |
| C. | 集气瓶中不可能既存在单质又存在化合物 | |
| D. | 集气瓶中可能含有一种单质和一种化合物 |
16.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
17.下列各组离子在水溶液中一定能大量共存的是( )
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
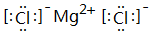 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.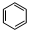 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$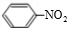 +H2O.
+H2O.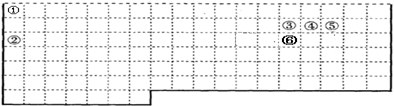
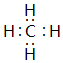 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.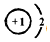 、
、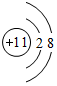 .
.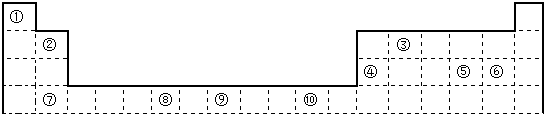
 .
. ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为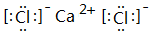 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
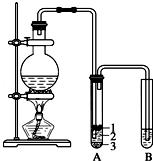 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: