题目内容
12.表为长式周期表的一部分,其中的编号代表对应的元素.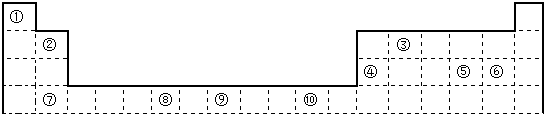
请回答下列问题:
(1)表中属于d区的元素是Cr、Fe(填元素符号).元素⑧的原子电子排布式为1s22s22p63s23p63d44s2,元素⑩形成的+1价阳离子的外围电子构型的轨道表示式为
 .
.(2)表中元素①与元素⑤形成的简单分子电子式为
 ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为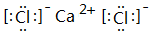 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的未成对电子数为3.元素⑤⑥⑦的原子半径由大到小的顺序为(用元素符号填空)Ca>S>Cl.
(4)表中十种元素最高氧化物对应水化物酸性最强的是HClO4(填水化物分子式,下同);碱性最强的是Ca(OH)2.
(5)周期表中处于对角线位置的元素的性质也有一定的相似性,如上表中元素④与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH═Na2BeO2+2H2O.
(6)1183K以下元素⑨形成的晶体的基本结构单元如图1所示,1183K以上转变为图2所示的基本结构单元,在两种晶体中最邻近的原子间距离相同.
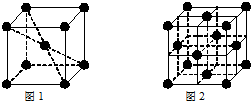
在1183K以下的晶体中,与⑨原子等距离且最近的⑨原子数为8个,在1183K以上的晶体中,与⑨原子等距离且最近的⑨原子数为12个.
分析 由元素在周期表中位置,可知①为H、②为Be、③为C、④为Al、⑤为S、⑥为Cl、⑦为Ca、⑧为Cr、⑨为Fe、⑩为Cu.
(1)ⅢB~ⅦB族(镧系元素、锕系元素除外)、第Ⅷ族属于d区元素;元素⑧为Cr,原子核外电子数为24,根据构造原理书写核外电子排布式;元素⑩形成的+1价阳离子为Cu+,其外围电子排布式为3d10,结合泡利原理画出轨道表示式;
(2)表中元素①与元素⑤形成的简单分子为H2S,属于共价化合物;⑥和⑦形成的化合物为CaCl2,由钙离子与氯离子构成;③和⑥形成的化合物为CCl4;元素①的4个原子与元素③的2个原子形成的分子为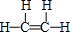 ;
;
(3)某元素的特征电子排布式为nsnnpn+1,由于s轨道只能容纳2个电子,故n=2,则该元素为N元素;同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)表中十种元素最高氧化物对应水化物酸性最强的是高氯酸;Ca的金属性最强,故氢氧化钙的碱性最强;
(5)元素④与元素②的氢氧化物有相似的性质,元素②的氢氧化物为Be(OH)2,与NaOH溶液反应反应生成Na2BeO2与水;
(6)元素⑨为Fe,在1183K以下的晶体为体心立方密堆积,晶胞体心原子与顶点8个原子相邻;在1183K以上的晶体为面心立方密堆积,以顶点原子研究,与之等距离且最近的原子出面心.
解答 解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为Al、⑤为S、⑥为Cl、⑦为Ca、⑧为Cr、⑨为Fe、⑩为Cu.
(1)上述元素中属于d区元素的是Cr、Fe;元素⑧为Cr,原子核外电子数为24,核外电子排布式为1s22s22p63s23p63d44s2,元素⑩形成的+1价阳离子为Cu+,其外围电子排布式为3d10,其轨道表示式为 ,
,
故答案为:Cr、Fe;1s22s22p63s23p63d44s2; ;
;
(2)表中元素①与元素⑤形成的简单分子为H2S,属于共价化合物,电子式为 ;⑥和⑦形成的化合物为CaCl2,由钙离子与氯离子构成,电子式为
;⑥和⑦形成的化合物为CaCl2,由钙离子与氯离子构成,电子式为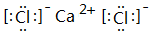 ;③和⑥形成的化合物为CCl4,属于分子晶体,元素①的4个原子与元素③的2个原子形成的分子为
;③和⑥形成的化合物为CCl4,属于分子晶体,元素①的4个原子与元素③的2个原子形成的分子为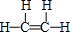 ,分子中含有σ键的数目为5,π键数目为1,
,分子中含有σ键的数目为5,π键数目为1,
故答案为: ;
;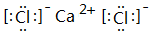 ;分子晶体;5;1;
;分子晶体;5;1;
(3)某元素的特征电子排布式为nsnnpn+1,由于s轨道只能容纳2个电子,故n=2,2p能级有3个轨道,3个电子优先占据一个轨道,有3个未成对电子,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Ca>S>Cl,
故答案为:3;Ca>S>Cl;
(4)表中十种元素最高氧化物对应水化物酸性最强的是HClO4;Ca的金属性最强,故Ca(OH)2的碱性最强,
故答案为:HClO4;Ca(OH)2;
(5)元素④与元素②的氢氧化物有相似的性质,元素②的氢氧化物为Be(OH)2,与NaOH溶液反应反应生成Na2BeO2与水,该反应方程式为:Be(OH)2+2NaOH═Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;
(6)元素⑨为Fe,在1183K以下的晶体为体心立方密堆积,晶胞体心原子与顶点8个原子相邻,故与⑨原子等距离且最近的⑨原子数为8,在1183K以上的晶体为面心立方密堆积,以顶点原子研究,与之等距离且最近的原子出面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,与⑨原子等距离且最近的⑨原子数为$\frac{8×3}{2}$=12,
故答案为:8;12.
点评 本题是对物质结构的考查,涉及元素周期表与元素周期律、核外电子排布、电子式、晶胞结构等,需要学生具备扎实的基础,(5)注意利用氢氧化铝的性质进行解答,难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 水污染的程度是由其溶氧量来测定 | |
| B. | 污染水的金属元素如汞、镉、铅等的含量极少时,不会对生物造成伤害 | |
| C. | 使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡 | |
| D. | 工业所排出的废水危害水生生物 |
| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
| A. | 对农作物合理施用化肥 | B. | 对废旧电池进行回收处理 | ||
| C. | 将塑料垃圾埋入地下或者倾倒入海 | D. | 使用沼气、太阳能、风能等代替煤炭 |
| N | O | F |
| P | S | Cl |
(2)N、P两种元素的最高价氧化物对应的水化物的酸性:HNO3>H3PO4(填“>”、“=”或“<”).
(3)O位于元素周期表中的第二周期ⅥA族族.
(4)S、Cl两种元素氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”).
| A. | 酸性:HXO4<H2Y O4<H3ZO4 | B. | 气态氢化物的稳定性:X<Y<Z | ||
| C. | 非金属性:X>Y>Z | D. | 元素负化合价的绝对值:X>Y>Z |
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 合成氨工业常采用Pt~Rh合金作为催化剂 | |
| D. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 |
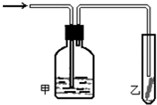
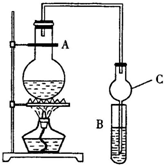 某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答: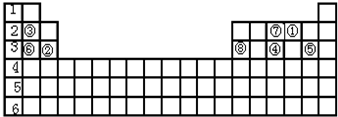
 ,与④的氢化物相比较,N的氢化物更稳定.
,与④的氢化物相比较,N的氢化物更稳定.