题目内容
13.已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素.A位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性.(1)E基态原子的价层电子排布式为3d64s2.第二周期基态原子未成对电子数与F相同且电负性最小的元素名称为碳.
(2)CD3-的空间构型为平面三角形.
(3)A、B、D三元素组成的一种化合物X是家庭装修材料中常含有的一种有害气体,X分子中的中心原子采用sp2杂化.
(4)F(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.根据等电子原理,B、D 分子内σ键与π键的个数之比为1:2.
(5)一种EF的合金晶体具有面心立方最密堆积的结构.在晶胞中,F位于顶点,E位于面心,该合金中EF的原子个数之比为3:1.若晶胞边长a pm,则合金密度为$\frac{226×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm3.
分析 A、B、C、D、E、F六种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A是H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B是C元素;D原子的核外成对电子数是未成对电子数的3倍,则D是O元素,C的原子序数大于B而小于D,则C是N元素;F为28号元素,则F是Ni元素;E的一种氧化物具有磁性,则E是Fe元素,以此来解答.
解答 解:(1)E是Fe元素,其原子核外有26个电子,根据构造原理知,基态Fe核外电子排布式为1s22s22p63s23p63d64s2,价电子排布为3d64s2;Ni原子未成对电子数是2,第二周期基态原子未成对电子数与F相同且电负性最小的元素名称为碳,
故答案为:3d64s2;碳;
(2)NO3-中价层电子对个数=3+$\frac{1}{2}$(5+1-3×2)=3且不含孤电子对,所以为平面三角形,
故答案为:平面三角形;
(3)A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则该M的化学式为HCHO,M分子中的中心原子价层电子对个数为3且不含孤电子对,所以采用sp2杂化,
故答案为:sp2;
(4)配合物Ni(CN)n的中心原子价电子数与配体提供电子总数之和为18,Ni原子价电子数是10,每个CN提供2个电子,则n=4,等电子体结构相似,CO和N2为等电子体,其结构相似,根据等电子原理,CO分子内σ键与π键个数之比为1:2,
故答案为:4;1:2;
(5)一种E和F的合金晶体具有面心立方最密堆积的结构,在晶胞中,Ni原子位于顶点,Fe原子位于面心,Ni原子个数=8×$\frac{1}{8}$=1,Fe原子个数=6×$\frac{1}{2}$=3,则该合金中E原子与F原子个数之比为3:1,若该晶胞的边长为apm,则合金的密度=$\frac{m}{V}$=$\frac{\frac{58+56×3}{{N}_{A}}}{{(a×1{0}^{-10})}^{3}}$=$\frac{226×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:$\frac{226×1{0}^{30}}{{a}^{3}{N}_{A}}$.
点评 本题考查晶胞计算及原子结构与元素周期律,为高频考点,把握电子排布、杂化理论、晶体结构为解答的关键,侧重分析与应用能力的考查,注意(5)为解答的难点,题目难度中等.

| A.爆竹声中一岁除-黑火药受热爆炸 | B.烈火赞烧若等闲-石灰石分解 | C.蜡烛成灰泪始干-石蜡的燃烧 | D.炉火照天地,红星乱紫烟-铁的冶炼 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | HCl→H++Cl- | B. | H2CO3?2H++CO32- | ||
| C. | NaCl→Na++Cl- | D. | NH3•H2O?NH4++OH- |
| A. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| B. | 水电离出的c (H+)=10-10 mol•L-1的溶液中Na+、K+、Cl?、HCO3? | |
| C. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、Cl-、SO42-、H2O2 |
| A. | 乙醇催化氧化可制备乙醛 | B. | 乙醇与H2反应可制备乙烷 | ||
| C. | 乙醇与金属钠反应可制备乙醇钠 | D. | 乙醇与乙酸反应可制备乙酸乙酯 |
| A. | NH5中N元素的化合价是+5价 | |
| B. | 1molNH5中含有5NA个N-H键 | |
| C. | NH5的电子式为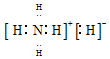 | |
| D. | NH5只由两种非金属元素组成,所以它是共价化合物 |
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |

 .
.