题目内容
11.某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )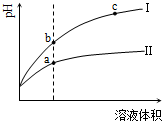
| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度小于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
分析 A.CH3COOH是弱酸,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,pH相同的醋酸和盐酸,c(CH3COOH)>c(HCl),加水稀释促进醋酸电离,pH相同的醋酸和盐酸稀释相同的倍数,pH变化大的是HCl、变化小的是醋酸;
B.离子积常数只与温度有关,与溶液酸性强弱无关;
C.II是醋酸、I是盐酸,pH相同的醋酸和盐酸,c(CH3COOH)>c(HCl),加水稀释相同的倍数,醋酸浓度仍然大于盐酸;
D.溶液导电性与离子浓度成正比.
解答 解:A.CH3COOH是弱酸,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,pH相同的醋酸和盐酸,c(CH3COOH)>c(HCl),加水稀释促进醋酸电离,pH相同的醋酸和盐酸稀释相同的倍数,pH变化大的是HCl、变化小的是醋酸,根据图知,II是醋酸、I是盐酸,故A错误;
B.离子积常数只与温度有关,与溶液酸性强弱无关,a、c两点溶液温度相同,其离子积常数相同,故B错误;
C.II是醋酸、I是盐酸,pH相同的醋酸和盐酸,c(CH3COOH)>c(HCl),加水稀释相同的倍数,醋酸浓度仍然大于盐酸,故C正确;
D.溶液导电性与离子浓度成正比,根据图知,c点pH大于b点,但b点氢离子浓度大于c点,所以b点导电能力大于c点,故D正确;
故选CD.
点评 本题以弱电解质的电离为载体考查学生识图能力,明确弱电解质电离特点及电解质溶液导电性影响因素是解本题关键,侧重考查学生分析判断能力,注意:电解质溶液导电性与离子浓度成正比,与电解质强弱无关,易错选项是D.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
16.下列叙述中正确的是( )
| A. | 物质的溶解过程,实质上就是其电离过程 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 1L0.1 mol•L-1的H2SO4溶液中含有0.2 molH+ | |
| D. | 1L0.1 mol•L-1的H2SO3溶液中含有0.2 molH+ |
3.下表是元素周期表的一部分,针对表中的①~=10 ⑩中元素,填空回答以下问题:
(1)在这些元素中,室温下其单质为液态的元素在上表中对应的“序号”是⑩,其原子的原子结构示意图为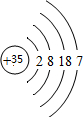 ;
;
(2)元素的最高价氧化物对应的水化物中酸性最强的是(填物质化学式,下同)HClO4,碱性最强的是KOH,
(3)②⑧⑩三种元素的氢化物中沸点最低的是(填氢化物化学式)HCl.
(4)室温下,其单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,此元素在上表中对应的“序号”是⑤,其单质是能与NaOH溶液反应生成H2的“非金属”,该元素在上表中对应的“序号”是⑥,此反应的化学方程式是:Si+2NaOH+H2O=Na2SiO3+2H2↑,
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,离子半径最小的序号是⑤;
(6)⑦与⑩不在同一周期,也不在同族,但可通过一个化学反应判断出其阴离子还原性的强弱,此反应的离子方程式为:Br2+S2-═2Br-+S.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)元素的最高价氧化物对应的水化物中酸性最强的是(填物质化学式,下同)HClO4,碱性最强的是KOH,
(3)②⑧⑩三种元素的氢化物中沸点最低的是(填氢化物化学式)HCl.
(4)室温下,其单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,此元素在上表中对应的“序号”是⑤,其单质是能与NaOH溶液反应生成H2的“非金属”,该元素在上表中对应的“序号”是⑥,此反应的化学方程式是:Si+2NaOH+H2O=Na2SiO3+2H2↑,
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,离子半径最小的序号是⑤;
(6)⑦与⑩不在同一周期,也不在同族,但可通过一个化学反应判断出其阴离子还原性的强弱,此反应的离子方程式为:Br2+S2-═2Br-+S.
20.关于下列图示的说法中正确的是( )
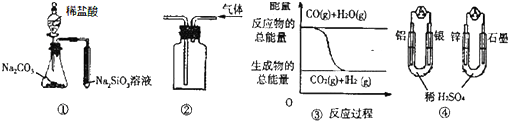

| A. | 用图 ①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图 ②所示实验装置排空气法收集CO2气体 | |
| C. | 图 ③表示反应 CO(g)+H2O(g)?CO2(g)+H2(g)是放热反应 | |
| D. | 图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
18.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丙烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |