题目内容
3.下表是元素周期表的一部分,针对表中的①~=10 ⑩中元素,填空回答以下问题:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)元素的最高价氧化物对应的水化物中酸性最强的是(填物质化学式,下同)HClO4,碱性最强的是KOH,
(3)②⑧⑩三种元素的氢化物中沸点最低的是(填氢化物化学式)HCl.
(4)室温下,其单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,此元素在上表中对应的“序号”是⑤,其单质是能与NaOH溶液反应生成H2的“非金属”,该元素在上表中对应的“序号”是⑥,此反应的化学方程式是:Si+2NaOH+H2O=Na2SiO3+2H2↑,
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,离子半径最小的序号是⑤;
(6)⑦与⑩不在同一周期,也不在同族,但可通过一个化学反应判断出其阴离子还原性的强弱,此反应的离子方程式为:Br2+S2-═2Br-+S.
分析 由元素在周期表中的位置可知,①为C,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为K,⑩为Br,
(1)室温下其单质为液态的为溴,原子核外有4的电子层,最外层电子数为7;
(2)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强;
(3)②⑧⑩三种元素的氢化物中HF含有氢键,沸点最高,HCl、HBr都不含氢键,相对分子质量越大,沸点越高;
(4)铝单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,Si单质是能与NaOH溶液反应生成H2;
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,⑤为同周期离子半径最小的元素,且核外电子排布排布相同的离子,核电荷数越大离子半径越小;
(6)可通过单质之间的置换反应证明阴离子还原性的强弱.
解答 解:由元素在周期表中的位置可知,①为C,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为K,⑩为Br,
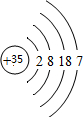
(1)室温下其单质为液态的为溴,原子核外有4的电子层,最外层电子数为7,原子结构示意图为 ,故答案为:⑩;
,故答案为:⑩; ;
;
(2)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,
故答案为:HClO4;KOH;
(3)②⑧⑩三种元素的氢化物中HF含有氢键,沸点最高,HCl、HBr都不含氢键,相对分子质量越大,沸点越高,则沸点最低的为HCl,故答案为:HCl;
(4)铝单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,Si单质是能与NaOH溶液反应生成H2,反应的化学方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:⑤;⑥;Si+2NaOH+H2O=Na2SiO3+2H2↑;
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,⑤为同周期离子半径最小的元素,且核外电子排布排布相同的离子,核电荷数越大离子半径越小,则最小的为⑤,
故答案为:⑧;⑤;
(6)可通过单质之间的置换反应证明阴离子还原性的强弱,反应如Br2+S2-═2Br-+S,故答案为:Br2+S2-═2Br-+S.
点评 本题考查位置、结构、性质的应用,元素的推断较简单,学生熟悉元素在周期表中的位置及元素、单质、化合物的性质即可解答,题目难度不大.

| A. | NO3- | B. | -Cl | C. | -OH | D. |  |
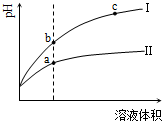
| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度小于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
| A. | 含1 mol NH3分子 | B. | 含NH3和NH4+之和为1mol | ||
| C. | 含NH3、NH4+、NH3•H2O之和为1 mol | D. | 含NH3•H2O 1mol |
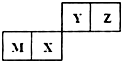
| A. | M与Z形成的化合物中只存在离子键 | |
| B. | X的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 原子半径Z>Y | |
| D. | M的最高价氧化物对应水化物能与NaOH溶液反应 |


 .
. .
.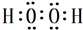 ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.
,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.