题目内容
4.用H2O2可除去工业尾气中的Cl2,相关反应:H2O2(1)+Cl2(g)$\stackrel{催化剂}{?}$2HCl(g)+O2(g)△H>0.为了提高H2O2的除氯效果,采取的措施最好的是适当升高温度(只改变一种条件),其原因是:该反应正反应是吸热反应,升温加快反应速率,平衡正向进行.
2H2O2(l)=2H2O(l)+O2(g),△H1=-196.46kJ•mol-l
H2(g)+$\frac{1}{2}$O2(g)=H2O(1),△H2=-285.84kJ•mol-l
Cl2(g)+H2(g)=2HCl(g),△H3=-184.6kJ•mol-l
则H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01KJ/mol.
分析 依据反应特征和影响反应速率和平衡移动的因素分析判断;由已知热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:①H2O2(l)+Cl2(g)?2HCl(g)+O2(g)△H>0,反应是吸热反应,为了提高H2O2的除氯效果,平衡正向进行,采取的措施最好的是适当升高温度,平衡正向进行;
a、2H2O2(l)=2H2O(l)+O2(g),△H1=-196.46kJ•mol-l
b、H2(g)+$\frac{1}{2}$O2(g)=H2O(l),△H2=-285.84kJ•mol-l
c、Cl2(g)+H2(g)=2HClO(g),△H3=-184.6kJ•mol-l
依据盖斯定律,a×$\frac{1}{2}$-b+c得到H2O2(l)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01KJ/mol;
故答案为:适当升高温度;该反应正反应是吸热反应,升温加快反应速率,平衡正向进行;H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01KJ/mol.
点评 本题考查了影响反应速率和平衡移动的因素以及热化学方程式的书写,注意盖斯定律的熟练应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
15.体积和pH值都相同的HCl和CH3OOH分别与足量NaHCO3反应,产生CO2的质量( )
| A. | 同样多 | B. | HCl最多 | C. | 醋酸最多 | D. | 无法判断 |
12.下列实验过程中,始终无明显现象的是( )
| A. | 在稀硫酸中加入铜粉,再加入KNO3固体 | |
| B. | SO2通入Ba(NO3)2溶液中 | |
| C. | CO2通入CaCl2溶液中 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体溶液中 |
11.某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )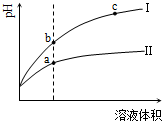

| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度小于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |

 ,实验中,可以观察到反应②的现象是:气体由无色变成红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变成红棕色.