题目内容
20.下列说法错误的是( )| A. | 某电中性单核粒子含有6个电子、7个中子,该粒子是${\;}_{6}^{13}$C | |
| B. | 在Na+、O2-、Cl、Cl-四种粒子中,半径最大的是Cl-,半径最小的是Na+ | |
| C. | 在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是A-x+n+24 | |
| D. | 硫离子的结构示意图为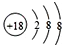 |
分析 A.原子含有6个电子,则质子数为6,即为C元素,质量数=质子数+中子数,据此回答;
B.电子层越多,半径越大;同一元素的不同离子,核外电子数越多,半径越大,以此来解答;
C.根据中子数=质量数-质子数,阴离子核外电子数=质子数+所带电荷数;
D.硫离子的核电荷数为16,核外电子总数为18,最外层含有8个电子,据此画出硫离子的离子结构示意图.
解答 解:A.某粒子含有6个电子、7个中子,呈电中性,应该是一种原子,原子含有6个电子,则质子数为6,即为C元素,质量数为6+7=13,则该原子是${\;}_{6}^{13}$C,故A正确;
B.同一元素的不同离子,核外电子数越多,半径越大,所以半径:Cl->Cl,Na>Na+;电子层越多,半径越大,所以半径:Cl>Na+,则粒子半径最大的是Cl-,半径最小的是Na+,故B正确;
C.R原子的质量数为A,设R原子核内含中子的数目为N,则R的质子数为A-N,离子RO3n-中共有x个核外电子,所以A-N+24+n=x,所以R原子核内含中子的数目N=A+n+24-x,故C正确;
D.硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,故D错误;
,故D错误;
故选D.
点评 本题主要考查了中子数、质量数、质子数之间的关系以及离子结构示意图的书写,题目难度不大,明确粒子符号的意义以及结构示意图的表示方法为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | S+O2═2SO2;△H=-269kJ/mol(反应热) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反应热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
8.下列叙述正确的是( )
| A. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw增大,pH不变 |
15.下列电子式中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A | 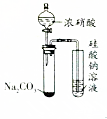 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| B | 向稀硝酸和稀硫酸中分别加入铁粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)3溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向盛有Fe(NO3)3溶液的试管中加入0.1mol•LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质属于共价化合物的是( )
| A. | NaBr | B. | N2 | C. | CaCl2 | D. | HCl |
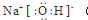 .
.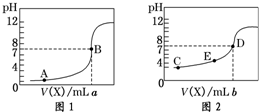 常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:
常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示: