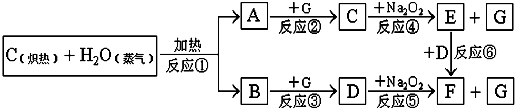
题目内容
10.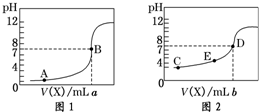 常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:
常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:则滴定HC1溶液的曲线是图1(填“图1”或“图2”),说明判断依据盐酸是强酸,0.10mol/L酸的pH为1.a与b的关系是:a>b(填“>”、“<”或“=”);E点对应离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
分析 如果酸为强酸,则0.10mol/L酸的pH为1,根据酸溶液的初始pH确定盐酸滴定曲线;溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性分析;b点氢氧化钠溶液的体积小于20mL,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,E点是酸性,所以c(OH-)<c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再结合电荷守恒判断离子浓度;
解答 解:如果酸为强酸,则0.10mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,盐酸溶液中滴入20.ooml氢氧化钠溶液恰好完全中和,醋酸溶液中滴入的氢氧化钠溶液小于20.00ml,a>b,根据图2知,b点氢氧化钠溶液的体积小于20mL,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,E点是酸性,所以c(OH-)<c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),则溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:图1;盐酸是强酸,0.10mol/L酸的pH为1;>;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
点评 本题考查了图象分析,酸碱反应定量关系和溶液酸碱性的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
20.下列说法错误的是( )
| A. | 某电中性单核粒子含有6个电子、7个中子,该粒子是${\;}_{6}^{13}$C | |
| B. | 在Na+、O2-、Cl、Cl-四种粒子中,半径最大的是Cl-,半径最小的是Na+ | |
| C. | 在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是A-x+n+24 | |
| D. | 硫离子的结构示意图为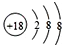 |
1.某碳酸钠样品中可能含有硫酸钠、氯化钠等杂质,为确定其所含杂质的具体成分,提出假设和具体实验方案.实验所需玻璃仪器任选,可供药品有:稀硫酸、稀硝酸、稀盐酸、NaOH稀溶液、AgNO3等溶液、BaCl2溶液、Ba(NO3)2溶液及蒸馏水等.
(1)苏品中可能含有的杂质:
假设1:只含有氯化钠;
假设2:只含有硫酸钠;
假设3:含Na2SO4和NaCl
(2)基于假设,李蕾同学进行了下列实验:取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀.该同学认为样品中含有硫酸钠.你认为李蕾同学的结论是否正确,并简述你的理由.结论正确(填“正确”、“不正确”或“无法确定”);理由是:加入稀盐酸,无明显现象,则一定不是AgNO3、Na2CO3,再加入BaCl2溶液,有白色沉淀产生,则该物质是Na2SO4
(3)若要求只能取一次样品,且实验要求连续进行.则为了验证“假设3”的正确性,陈丹同学设计了如表所示的实验方案,请你在空格中填入相关内容,完善实验方案.
(1)苏品中可能含有的杂质:
假设1:只含有氯化钠;
假设2:只含有硫酸钠;
假设3:含Na2SO4和NaCl
(2)基于假设,李蕾同学进行了下列实验:取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀.该同学认为样品中含有硫酸钠.你认为李蕾同学的结论是否正确,并简述你的理由.结论正确(填“正确”、“不正确”或“无法确定”);理由是:加入稀盐酸,无明显现象,则一定不是AgNO3、Na2CO3,再加入BaCl2溶液,有白色沉淀产生,则该物质是Na2SO4
(3)若要求只能取一次样品,且实验要求连续进行.则为了验证“假设3”的正确性,陈丹同学设计了如表所示的实验方案,请你在空格中填入相关内容,完善实验方案.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀硝酸 | 有气体产生,说明样品中含有Na2CO3 |
| ② | 向试管中加入足量Ba(NO3)2溶液 | 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4 |
| ③ | 若②操作无沉淀,则向试管中加入0.1mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1mol•L-1AgNO3溶液 | 有沉淀产生,则含NaCl;无沉淀产生,则不含NaCl |
5.下列对分子结构叙述正确的是( )
| A. | H2O2分子中,两个O之间形成2对共用电子对 | |
| B. | N2的电子式是N┇┇N | |
| C. | CO2和CS2都是直线型分子 | |
| D. | 白磷和甲烷都是正四面体型,键角都是109°28′ |
15.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 乙烯和乙炔 | B. | 苯和己烷 | C. | 苯和甲苯 | D. | 溴苯和溴乙烷 |
2.下列分析问题的因果关系正确的是( )
| A. | 冰的密度比液态水的密度小是因为冰分子之间含有较强的化学键 | |
| B. | 氨分子的键角比甲烷分子的键角小是因为两个分子中中心原子的杂化方式不同 | |
| C. | HF的沸点比HCl的沸点高是因为HF分子内含有氢键 | |
| D. | HF比HCl稳定是因为HF分子中共价键的键能大 |
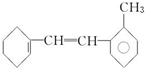 有机物结构简式如下:
有机物结构简式如下: .
.