题目内容
6.密闭容器中,反应xA(g)+yB(g)?zC(g)达到平衡时,A的浓度为0.5mol•L-1,若保持温度不变,将容器的容积扩大原来的2倍,达到新平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是( )| A. | x+y<n | B. | 该化学平衡向正方向移动 | ||
| C. | B的转化率增大 | D. | C的体积分数减小 |
分析 xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.3mol/L,则说明体积增大(压强减小)化学平衡逆向移动,逆向是气体体积增大的反应,以此来解答.
解答 解:由信息可知,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,再达到平衡时测得A的浓度为0.3mol/L,体积增大,相当于压强减小,化学平衡逆向移动,逆向是气体体积增大的反应则,
A.由上述分析可知,平衡逆向移动,逆向是气体体积增大的反应,x+y>n,故A错误;
B.由上述分析可知,平衡逆向移动,故B错误;
C.平衡逆向移动,B的转化率减小,故C错误;
D.平衡逆向移动,C的体积分数减小,故D正确;
故选D.
点评 本题考查化学平衡的移动,注意A的浓度变化及体积变化导致的平衡移动是解答本题的关键,熟悉压强对化学平衡的影响即可解答,题目难度中等.

练习册系列答案
相关题目
14.在一定温度固定容积的密闭容器中充入2molNO2发生反应2NO2(g)?N2O4(g)达到平衡后,在恒温恒容条件下,再向容器内通入2molNO2,又达到新平衡时NO2的体积分数( )
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
1.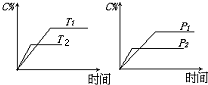 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,若升温,平衡向逆方向移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,增加A的量有利于平衡向正方向移动 |
11.下列鉴别物质的方法能达到目的是( )
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 某溶液中滴加盐酸能产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含CO32- | |
| D. | 向某溶液中加入BaCl2溶液出现白色沉淀,再加入HCl溶液,白色沉淀不溶解,则该溶液中肯定有SO42- |
13.下列有关化学用语表示正确的是( )
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 亚硫酸钠水解的离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
13.下列离子方程式不正确的是( )
| A. | 碳酸钙与稀盐酸混合:CO32-+2H+=CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
 反应是 ( )
反应是 ( )
 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0