题目内容
14.在一定温度固定容积的密闭容器中充入2molNO2发生反应2NO2(g)?N2O4(g)达到平衡后,在恒温恒容条件下,再向容器内通入2molNO2,又达到新平衡时NO2的体积分数( )| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
分析 在恒温恒容条件下,再向容器内通入2molNO2,等效为在原平衡的基础上压强增大1倍,平衡右移,据此解答.
解答 解:在恒温恒容条件下,再向容器内通入2molNO2,等效为在原平衡的基础上压强增大1倍,平衡右移,NO2的体积分数减少,N2O4的体积分数增大,故选C.
点评 本题考查化学平衡的影响因素,难度中等,构建平衡建立的途径是解题的关键,注意对等效平衡的理解,有一定的难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.已知:可逆反应A(g)+B(g)?2C(g)+D(s)△H<0,一定条件下达到平衡后,改变下列条件,一定能使平衡向逆反应方向移动的是( )
| A. | 升温 | B. | 加压 | C. | 增加D的量 | D. | 加入催化剂 |
19.下列可逆反应达到平衡后,加压或降低温度都可使平衡向逆方向移动的是( )
| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
6.密闭容器中,反应xA(g)+yB(g)?zC(g)达到平衡时,A的浓度为0.5mol•L-1,若保持温度不变,将容器的容积扩大原来的2倍,达到新平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是( )
| A. | x+y<n | B. | 该化学平衡向正方向移动 | ||
| C. | B的转化率增大 | D. | C的体积分数减小 |
3.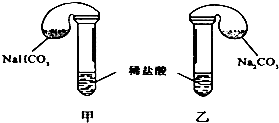 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+═H2O+CO2↑.
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格.
 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+═H2O+CO2↑.
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格.
| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
1.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下11.2L的水中含有0.5 NA个水分子 | |
| B. | 22.4LN2所含的电子数是14NA个 | |
| C. | 常温常压下,1 mol N2和NO的混合气体中含2NA个原子 | |
| D. | 含107g Fe(OH)3的胶体中胶粒总数为NA个 |

 ,放出28
,放出28 .
.