题目内容
18.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法该法的工艺流程为:
CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②}^{Fe_{3}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
其中第①步存在平衡:2CrO${\;}_{4}^{2-}$(黄色)+2H+?CrO${\;}_{7}^{2-}$(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显橙色.
(2)能说明第①步反应达平衡状态的是ac(填字母).
a.2v正(Cr2O${\;}_{7}^{2-}$)═v逆(CrO${\;}_{4}^{2-}$)
b.Cr2O${\;}_{7}^{2-}$和CrO${\;}_{4}^{2-}$的浓度相同
c.溶液的颜色不变
(3)完成第②步中氧化还原反应的离子方程式:( )Cr2O${\;}_{7}^{2-}$+( )Fe2++( )H+═( )Cr3++( )Fe3++( )H2O
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积K30=c(Cr3+)•c3(OH-)=1×10 -32,要使Cr3+沉淀完全(Cr3+浓度等于或小于1×10-5mol.L-l时,Cr3+已沉淀完全),溶液的pH至少应调至5
方法2:电解法
该法用Fe做电极电解含Cr2O72-;的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+.
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)2H++2e-=H2↑.溶液中同时生成的沉淀还有Fe(OH)3(填化学式).
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)第②步中的氧化还原反应为亚铁离子被重铬酸钾氧化生成铬离子和亚铁离子,根据电荷守恒和元素守恒书写离子方程式;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
a.当2v正(Cr2O${\;}_{7}^{2-}$)═v逆(CrO${\;}_{4}^{2-}$)时,说明正逆反应速率相等,故反应处于平衡状态,故a正确;
b.Cr2O72-和CrO42-的浓度相同,不一定平衡,故b错误;
c.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故c正确;
故答案为:ac;
(3)第②步中的氧化还原反应为亚铁离子被重铬酸钾氧化生成铬离子和亚铁离子,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:1、6、14H+、6、2、7H2O;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\root{3}{\frac{Ksp}{c(Cr{\;}^{3+})}}$=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,
故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑;Fe(OH)3.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键,注意把握氧化还原反应原理以及溶度积在计算中的应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 升温 | B. | 加压 | C. | 增加D的量 | D. | 加入催化剂 |
| A. | x+y<n | B. | 该化学平衡向正方向移动 | ||
| C. | B的转化率增大 | D. | C的体积分数减小 |
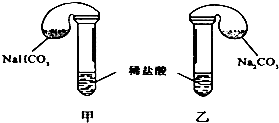 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+═H2O+CO2↑.
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格.
| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
| A. | 取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 | |
| B. | 硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量硫酸亚铁铵晶体放入试管,加入浓氢氧化钠溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
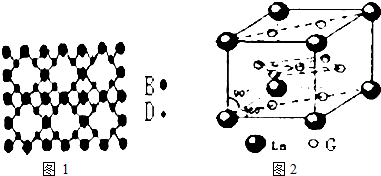 现有A、B、D、E、F、G六种前四周期元素,它们的原子序数依次增大,E、F同主族,A、B的最外层电子数之和与D的最外层电子数相等,A、D、E的质子数之和与F的原子序数相等,A能分别与B、D、E形成电子总数相等的分子.E、F均能形成多种同素异形体,G2+的3d能级有8个电子.
现有A、B、D、E、F、G六种前四周期元素,它们的原子序数依次增大,E、F同主族,A、B的最外层电子数之和与D的最外层电子数相等,A、D、E的质子数之和与F的原子序数相等,A能分别与B、D、E形成电子总数相等的分子.E、F均能形成多种同素异形体,G2+的3d能级有8个电子. .(不考虑空间构型)
.(不考虑空间构型)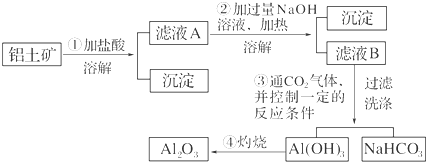
 .
.