题目内容
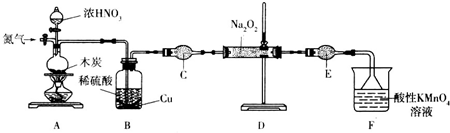
20.ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水.制备方法如下: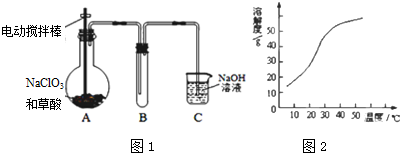
(1)步骤Ⅰ:电解食盐水制备氯酸钠.用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质.在除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是2:1.
(3)学生拟用如图1所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃时反应制得.
反应过程中需要对A容器进行加热,加热的方式为水浴加热;加热需要的玻璃仪器除酒精灯外,还有温度计、大烧杯;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液.已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的是NaClO2.根据如图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2•3H2O的操作步骤:①蒸发浓缩;②冷却(大于38℃)结晶;③洗涤;④干燥.
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中.现制取270kg二氧化氯,需要亚氯酸钠的质量是362kg.
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
分析 (1)溶液中的杂质离子为钙离子、镁离子和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀除去,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,所以往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去;
(2)根据NaClO3与盐酸反应生成ClO2与Cl2的反应可知,生成每摩尔Cl2失去2mol电子,而生成每摩尔ClO2得到1mol电子,根据电子得失守恒计算;
(3)工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得ClO2、K2CO3和CO2,所以反应要用水浴加热;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(5)根据氯气与亚氯酸钠反应的化学方程式和二氧化氯的质量,列出比例式,就可计算出参加反应的亚氯酸钠的质量;
(6)处理含CN-相同量的电镀废水时,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,其次除杂操作时,往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3,和NaOH溶液,充分反应后将沉淀一并滤去;
故答案为:BaCl2;Na2CO3;
(2)根据NaClO3与盐酸反应生成ClO2与Cl2的反应可知,生成每摩尔Cl2失去2mol电子,而生成每摩尔ClO2得到1mol电子,根据电子得失守恒可知,生成ClO2与Cl2的物质的量比是2:1,
故答案为:2:1;
(3)工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得ClO2、K2CO3和CO2,所以反应要用水浴加热,为了准确测量水浴的温度需要用温度计,另外水浴装置中除酒精灯外,还需要用大烧杯,
故答案为:水浴加热;温度计、大烧杯;
(4)从溶液中制取溶质,一般采用蒸发浓缩、冷却(大于38℃)结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,趁热过滤;用38℃~60℃热水洗涤;低于60℃干燥;
故答案为:蒸发浓缩; 冷却(大于38℃)结晶;
(5)设亚氯酸钠的质量是为xkg,
根据反应 2NaClO2+Cl2=2NaCl+2ClO2
181 135
x 270kg
所以x=$\frac{270kg×181}{135}$=362
故答案为:362kg;
(6)处理含CN-相同量的电镀废水时,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,
故答案为:2.5.
点评 本题考查化学工艺流程,涉及氧化还原反应电子转移计算,化学实验基本方法(除杂)等相关知识,题目难度中等,注意把握物质的分离、提纯操作方法,题目难度不大,该部分内容是高考的热点,掌握基础是关键.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作会造成测定结果偏高的是CD(填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②某学生的实验操作如下:
A.用碱式滴定管取稀NaOH溶液25.00mL,注入锥形瓶中,加入甲基橙作指剂
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以 上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
a.滴定操作的正确顺序是(用序号填写)ECBADGF;
b.在G操作中如何确定滴定终点?当滴进最后一滴溶液由黄色变橙色,且半分钟内不变色.
(2)氧化还原滴定:取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+22MnSO4+8H2O,表格记录了实验数据:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2mol/L.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,
充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水.
(3)②中除去Fe3+所发生的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)B、D、C、E、A、F;
(2)上述B步骤操作的目的是防止滴定管内壁的水将标准液稀释;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是增大.(填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为酚酞试液,判断到达滴定终点的实验现象是:当滴入最后一滴溶液时,锥形瓶中溶液有无色变为浅红色,且半分钟不褪色;
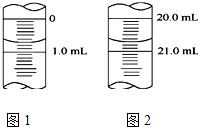
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为0.70mL,图2为滴定结束液面,则本次滴定过程共使用了20.00mLKOH标准溶液
(6)为标定某醋酸溶液的准确浓度,用0.1000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
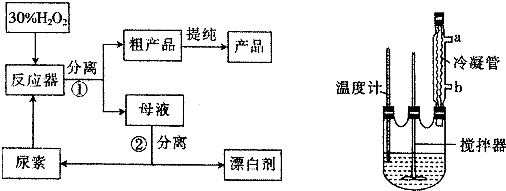
过氧化尿素的部分参数见表:
| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
(2)反应器中发生反应的化学方程式为CO(NH2)2+H2O2=CO(NH2)2•H2O2;
(3)反应器中冷凝管中的冷水从b(填“a”或“b”)口流进,反应器加热温度不能太高的原因是温度过高,产品易分解,致使活性氧含量降低;
(4)搅拌器不能选择铁质或铝质材料的原因是铝、铁易被氧化;
(5)为测定产品中过氧化尿素的含量,称取干燥样品12.0g,溶于水,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL6mol/L硫酸,然后用0.20mol/L的KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如表:
| 实验序号 | 1 | 2 | 3 | |
| KMnO4溶液的体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
| 滴定后读数 | 19.98 | 20.00 | 22.02 | |
②若滴定前滴定管尖嘴处无气泡,滴定后有气泡.则会使测得的过氧化尿素的含量偏低 (填“偏高”“偏低”或“不变”).
③产品中过氧化尿素的质最分数为78.3%.
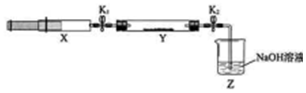
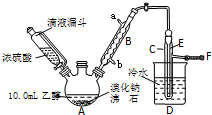 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见下表:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓磷酸顺利流下
(3)氢溴酸与浓硫酸混合加热发生氧化还原的化学方程式为2HBr+H2SO4(浓)=Br2+SO2↑+2H2O
(4)加热A的目的是加快反应速率,蒸馏出溴乙烷,F接橡皮管导入稀NaOH溶液,其目的是吸收SO2、溴乙烷和溴蒸汽,防止防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其原因是冷却并减少溴乙烷的挥发.
(6)将C中的馏出液转入锥形瓶中,边振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,然后经过操作M,使经硫酸处理后的溴乙烷转入蒸馏瓶,加热蒸馏,收集到38~40℃的馏分约9.3g.
①操作M的名称为分液;为了控制38~40℃,加热使用水浴加热法
②从乙醇的角度考虑,本实验所得溴乙烷的产率是49.7%
(乙醇的相对分子质量为46,溴乙烷的相对分子质量为109)