题目内容
18.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.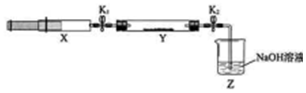
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
分析 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应生成无色氮气,所以看到现象为:红棕色变浅;
依据8NH3+6NO2=7N2+12H2O以及气态水凝聚判断,反应后气体分子数减少从而判断打开K2发生的现象.
解答 解:打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应 生成无色氮气,所以看到现象为:红棕色气体慢慢变浅;
根据反应8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O以及装置恢复至室温后气态水凝聚可判断,反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸;
故答案为:
| 操作步骤 | 实验现象 | 解释原因 |
| 红棕色气体慢慢变浅 | 8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O | |
| Z中NaOH溶液产生倒吸现象 | 反应后气体分子数减少,Y管中压强小于外压 |
点评 本题考查了氮氧化物的性质和反应现象的分析判断,明确装置的原理及制备气体的一般程序是解题关键,题目难度不大.

练习册系列答案
相关题目
6.如表是不同温度下水的离子积常数:
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
13.下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
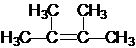 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯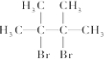
 .
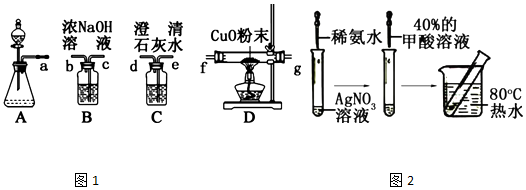
.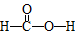 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: