题目内容
10.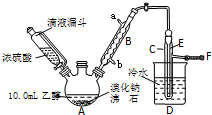 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见下表:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓磷酸顺利流下
(3)氢溴酸与浓硫酸混合加热发生氧化还原的化学方程式为2HBr+H2SO4(浓)=Br2+SO2↑+2H2O
(4)加热A的目的是加快反应速率,蒸馏出溴乙烷,F接橡皮管导入稀NaOH溶液,其目的是吸收SO2、溴乙烷和溴蒸汽,防止防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其原因是冷却并减少溴乙烷的挥发.
(6)将C中的馏出液转入锥形瓶中,边振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,然后经过操作M,使经硫酸处理后的溴乙烷转入蒸馏瓶,加热蒸馏,收集到38~40℃的馏分约9.3g.
①操作M的名称为分液;为了控制38~40℃,加热使用水浴加热法
②从乙醇的角度考虑,本实验所得溴乙烷的产率是49.7%
(乙醇的相对分子质量为46,溴乙烷的相对分子质量为109)
分析 (1)液体加热加入沸石,可以防止液体瀑沸,B为球形冷凝管,应采取逆流原理通入冷凝水,进行充分冷凝回流;
(2)滴液漏斗可以使漏斗的上方和下方的压强相等,使浓磷酸顺利流下;
(3)氢溴酸具有还原性,能被浓硫酸氧化,生成溴单质,浓硫酸被还原成二氧化硫;
(4)给A加热可以加快反应速率蒸出溴乙烷;实验中产生的二氧化硫、溴化氢、溴等可以用稀NaOH溶液吸收;
(5)通过E的末端插入水面以下冷却减少溴乙烷的挥发;
(6)①两种互不相容的液体分离用分液,化学反应的条件温度在常温之上,100℃以下采用水浴加热;
②10mL乙醇的质量为0.79×10g=7.9g,其物质的量为0.172mol,所以理论制得溴乙烷的物质的量为0.172mol,其质量为18.75g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)液体加热加入沸石,可以防止液体瀑沸,B为球形冷凝管,应采取逆流原理通入冷凝水,进行充分冷凝回流,所以B中进水口为b,
故答案为:防止液体瀑沸;b;
(2)滴液漏斗可以使漏斗的上方和下方的压强相等,使浓磷酸顺利流下,而分液漏斗没有这个功能,
故答案为:平衡压强,使浓磷酸顺利流下;
(3)氢溴酸具有还原性,能被浓硫酸氧化,生成溴单质,浓硫酸被还原成二氧化硫,反应的方程式为2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,所以不能用浓H2SO4代替浓磷酸,
故答案为:2HBr+H2SO4(浓)=Br2+SO2↑+2H2O;
(4)加热的目的是加快反应速率,温度高于38.4℃溴乙烷全部挥发蒸馏出来,实验中产生的二氧化硫、溴化氢、溴等会污染空气,所以可以用稀NaOH溶液吸收;
故答案为:加快反应速率,蒸馏出溴乙烷;SO2;防止空气污染;
(5)导管E的末端须在水面以下,通过冷却得到溴乙烷,减少溴乙烷的挥发;
故答案为:冷却并减少溴乙烷的挥发;
(6)①两种互不相容的液体分离用分液,化学反应的条件温度在常温之上,100℃以下采用水浴加热;
故答案为:分液;水浴加热;
②10mL乙醇的质量为0.79×10g=7.9g,其物质的量为0.172mol,所以理论制得溴乙烷的物质的量为0.172mol,其质量为18.75g,所以溴乙烷的产率=$\frac{9.3g}{18.75g}$×100%=49.7%,
故答案为:49.7%.
点评 本题考查有机物制备实验,涉及实验室HBr的制备、物质的分离提纯、对操作与原理的分析评价等,综合考查学生实验分析的能力、知识迁移运用能力,题目难度中等.

| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
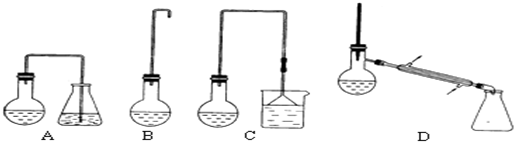
(1)制备1-溴丁烷的装置应选用上图中的C(填序号).反应加热时的温度不宜超过100℃,理由是防止1-溴丁烷因气化而逸出,影响产率且温度太高,浓硫酸氧化性增强,可能氧化溴化氢.
(2)制备操作中,加入的浓硫酸和溴化钠的作用是二者反应生成HBr.
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是D,(填序号);该操作应控制的温度(t)范围是101.6℃≤t<117.25℃.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.Na2SO3 d.KCl.
(1)实验室制备FeCO3的流程如下:
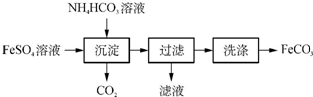
①写出生成沉淀的化学方程式:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O.
②检验滤液中含有NH4+的方法是取少量滤液于试管中,加入足量NaOH溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有NH4+.
(2)甲同学为了验证FeCO3高温下煅烧是否得到Fe2O3,做了如表实验:
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
①实验步骤Ⅲ中溶液变红的离子方程式为Fe3++3SCN-=Fe(SCN)3.
②乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后D(填字母),用来检验溶液中是否含有Fe2+.
A.滴加氯水B.滴加KSCN溶液
C.先滴加KSCN溶液后滴加氯水D.滴加酸性KMnO4溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物即为Fe3O4.
①丙同学持此看法的理由是氧化亚铁、四氧化三铁中也是含有+2价铁元素的.
②丙同学查阅资料得知煅烧FeCO3的产物中含有+2价铁元素,于是他设计了由FeCO3制备Fe2O3的方案.先向FeCO3粉末中依次加入试剂:稀硫酸、氯水和氢氧化钠;然后再过滤(填操作)、洗涤、灼烧即可得到Fe2O3.
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(CH3COOH,g/100mL).
(一)、实验用品:市售食用白醋样品500mL(商标注明:总酸量:3.5g-5g/100mL)(下称“原醋”),0.1000mol/LNaOH标准溶液,蒸馏水,0.1%甲基橙溶液、0.1%酚酞溶液;仪器自选.
(二)、实验原理:化学方程式CH3COOH+NaOH=CH3COONa+H2O
(三)、实验步骤:
(1)配制待测食醋溶液
准确量取10.00mL原醋,配制成100.00mL待测食醋溶液(下称“待测液”).完成该步骤,需要的一种定量仪器是100ml容量瓶(填仪器名称)
(2)量取一定体积的待测液
用酸式滴定管取20.00mL待测液于锥形瓶中.加1-2滴0.1%酚酞溶液做指示剂
(3)盛装标准NaOH溶液,记录为NaOH标准溶液体积的初读数.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内溶液颜色变化直到滴定终点.判断滴定终点的现象是由无色变为浅红色,半分钟内不褪色.
记录NaOH的终读数.重复滴定4次.
(四)、实验记录及数据处理(请完成相关填空)
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(待测液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.95 | 15.20 | 15.15 | 16.95 |
| V(NaOH)/mL(消耗) | 14.95 | 15.00 | 15.05 | 16.95 |
(6)消耗NaOH溶液的平均值是15.00mL.
(7)待测液的浓度是0.075mol/L.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
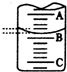
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体 积大于24.60ml.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水洗涤,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L.
| A. | 明矾 | B. | 铝热剂 | C. | 赤铁矿 | D. | 不锈钢 |
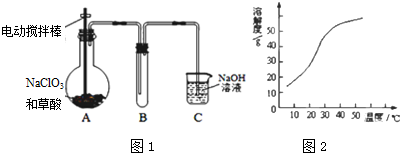
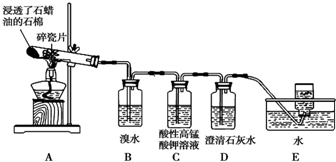
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.