题目内容
3.同温同压下,相同体积的甲烷(CH4)和二氧化碳.(1)分子数之比1:1,(2)原子总数之比5:3,(3)质量之比4:11,(4)密度之比4:11.
分析 同温同压下,相同体积的气体物质的量相同,根据物质的量和分子组成计算原子个数关系,根据物质的量和气体的摩尔质量计算质量和密度关系.
解答 解:同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3,
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
体积相同,则密度之比等于物质的质量之比,也为4:11,
故答案为:1:1;5:3;4:11;4:11.
点评 本题考查物质的量的有关计算,以及阿伏伽德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.

练习册系列答案
相关题目
4.某课外小组的同学设计了以下装置(部分夹持仪器已略)制取无水AlCl3(易升华),其中不能达到相应实验目的是( )
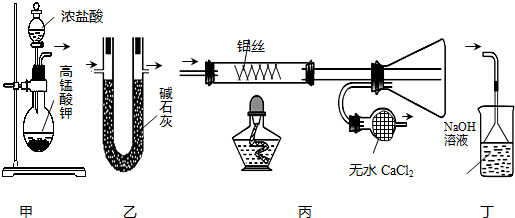

| A. | 用装置甲制取氯气 | B. | 用装置乙干燥氯气 | ||
| C. | 用装置丙制取并收集AlCl3 | D. | 用装置丁处理丙中排出的尾气 |
14.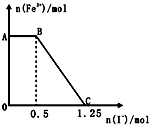 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A. | 图中AB段主要是高锰酸钾和碘化钾溶液反应 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | |
| D. | 向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
11.能正确表示下列反应的离子方程式( )
| A. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O | |
| B. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++O3-═3Fe3++NO↑+2H2O | |
| C. | 硝酸银溶液中加入铜粉:Cu+Ag+═Cu2++Ag | |
| D. | 常温下,浓硝酸与铁屑混合:2Fe+6H+═2Fe3++3H2↑ |
18.下列有关NaHCO3与Na2CO3的说法中,正确的是( )
| A. | 分别加热两种样品,没有残留物质是NaHCO3 | |
| B. | 分别配成溶液,再加入澄清石灰水,无白色沉淀生成的是NaHCO3 | |
| C. | 分别与相同物质的量浓度的盐酸反应,产生CO2的速率Na2CO3>NaHCO3 | |
| D. | 常温时在水中的溶解度:Na2CO3>NaHCO3 |
8.化学与生活密切相关.下列说法不正确的是( )
| A. | 用含增塑剂的聚氯乙烯薄膜作食品包装材料 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 中国古代用明矾溶液的酸性清洗铜镜表面的铜锈 |
15.下列关于热化学反应的描述中正确的是( )
| A. | H2SO4和NaOH反应的中和热是HCl和NaOH反应的中和热的两倍 | |
| B. | CO的标准燃烧热是△H=-283.0KJ/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 甲烷完全燃烧生成液态水和二氧化碳气体所放出的热量是甲烷的标准燃烧热 |
12.100mL 6mol•L-1的硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(固体) | B. | 氨水 | C. | 碳酸氢钠溶液 | D. | 水 |
13.下列实验或操作过程中一定有氧化还原反应发生的是( )
| A. | 分离、提纯NaCl与KNO3混合物中的KNO3 | |
| B. | 将NaCl溶液蒸发、结晶转变为NaCl固体 | |
| C. | 用四氯化碳萃取溴水中的溴 | |
| D. | 实验室利用KMnO4与浓盐酸反应制备氯气(Cl2) |