题目内容
15.下列关于热化学反应的描述中正确的是( )| A. | H2SO4和NaOH反应的中和热是HCl和NaOH反应的中和热的两倍 | |
| B. | CO的标准燃烧热是△H=-283.0KJ/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 甲烷完全燃烧生成液态水和二氧化碳气体所放出的热量是甲烷的标准燃烧热 |
分析 A.中和热是指强酸强碱的稀溶液完全反应生成1mol水放出的热量;
B.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,反应焓变符号随之变化;
C.加热反应不一定是吸热反应,某些放热反应也需要引发条件;
D.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,和可燃物的量有关;
解答 解:A.中和热是指强酸强碱的稀溶液完全反应生成1mol水放出的热量,H2SO4和NaOH反应的中和热是HCl和NaOH反应的中和热的相同,故A错误;
B.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,反应焓变符号随之变化,系数加倍焓变随之加倍,CO的标准燃烧热是△H=-283.0KJ/mol,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol,故B正确;
C.加热反应不一定是吸热反应,某些放热反应也需要引发条件,如铝热反应是放热反应,但需要引发条件加热才能进行,故C错误;
D.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,和可燃物的量有关,1mol甲烷完全燃烧生成液态水和二氧化碳气体所放出的热量是甲烷的标准燃烧热,故D错误;
故选B.
点评 本题考查了燃烧热、中和热概念的理解应用,方程式书写方法,注意概念的条件和实质分析,题目较简单.

练习册系列答案
相关题目
10.室温下,下列溶液中粒子浓度关系不正确的是( )
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
20.下列含有共价键的离子化合物( )
| A. | MgCl2 | B. | CO2 | C. | KOH | D. | C2H6 |
7.既能与酸反应,又能与碱反应的是( )
①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤NH4HS ⑥CaCO3 .
①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤NH4HS ⑥CaCO3 .
| A. | ② | B. | ②③④ | C. | ②④⑤ | D. | ②③④⑤ |
5.下表中评价合理的是( )
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓正确 | |
| B. | 向碳酸镁中加入稀盐酸:CO32-+2H+═CO2↑+H2O 错误,碳酸镁不应该写成离子形式 | |
| C. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓正确 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O 错误,反应物和产物的配比不正确 |
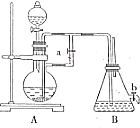 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的须色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的须色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.