题目内容
10g CO和H2组成的混合气体在足量氧气中完全燃烧,立即将全部生成物通入足量的Na2O2中,则固体质量增加( )
| A、10g | B、11.8g |
| C、13.2g | D、无法计算 |
考点:化学方程式的有关计算
专题:计算题
分析:利用差量法,根据化学方程式分析:
CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.
2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;
2H2+O2
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.
CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.
2CO+O2
| ||
2H2+O2
| ||
解答:
解:2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,
质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;
2H2+O2
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,
质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.
所以固体质量的增加量就是原混合气体的质量,为10g,
故选A.
| ||
质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;
2H2+O2
| ||
质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.
所以固体质量的增加量就是原混合气体的质量,为10g,
故选A.
点评:本题考查混合物的计算,难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,此为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )| A、常温常压下,L是一种液态有机物 |
| B、E的二溴代物只有一种结构 |
| C、G具有强氧化性和漂白性 |
| D、上述反应的类型是加成反应 |
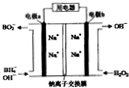 以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )
以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )| A、该电池工作时Na+由a极区移向b极区 |
| B、正极材料采用MnO2,MnO2既做电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-→BO2-+6H2O |
| D、电路中通过6.02×1022个电子时,理论上消耗H2O2 0.1mol |
我们生活在千变万化的物质世界里.下列变化中,没有发生氧化还原反应的是( )
| A、爆竹爆炸 | B、木炭燃烧 |
| C、蒸发 | D、电解水 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1mol甲与足量的乙完全反应共转移了1mol电子 |
| D、1.0L0.1mol?L-1戊溶液中阴离子总数为0.1NA |
化学与生活密切相关.下列生活中常见物质的俗名或名称与化学式相对应的是( )
| A、小苏打--Na2CO3 |
| B、烧碱--NaOH |
| C、甲醛--CH3OH |
| D、明矾--KAl(SO4)2 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、2.24L氨气中氨分子数目为0.2NA |
| B、1mol甲基中电子数目为9NA |
| C、1L0.1mol?L-1NaHCO3溶液中氧原子数目为0.3NA |
| D、7.8gNa2O2与足量H2O反应,转移电子数目为0.2NA |
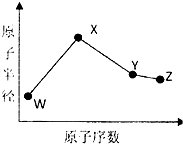 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.