题目内容
绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成分.如图1是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
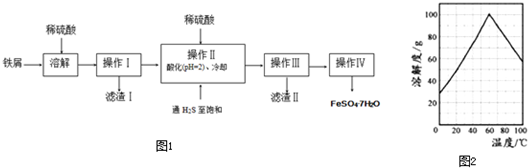
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 .
(2)检验制得的绿矾晶体中是否含有Fe3+的实验操作是
(3)请结合图2的绿矾溶解度曲线,补充完整操作IV制备FeSO4?7H2O晶体的实验步骤为 .
(4)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4-□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取3.7200g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①在滴定实验中不能选择 式滴定管,理由是 ;
②计算上述样品中FeSO4?7H2O的质量分数为 (用小数表示,保留两位小数).

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)操作II中,通入硫化氢至饱和的目的是
(2)检验制得的绿矾晶体中是否含有Fe3+的实验操作是
(3)请结合图2的绿矾溶解度曲线,补充完整操作IV制备FeSO4?7H2O晶体的实验步骤为
(4)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4-□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取3.7200g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①在滴定实验中不能选择
②计算上述样品中FeSO4?7H2O的质量分数为
考点:探究物质的组成或测量物质的含量,物质分离和提纯的方法和基本操作综合应用
专题:实验题
分析:(1)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(2)可用KSCN溶液检验铁离子的存在;
(3)由市售铁屑(含少量锡、氧化铁等杂质)为原料制备FeSO4?7H2O晶体,要弄清楚流程中每一步的原理和注意事项;向铁屑中加入足量的稀硫酸,Fe2O3、铁,少量锡均会与硫酸反应,最终生成二价铁、二价锡,先过滤除去不溶物,然后向滤液中加入稀硫酸和硫化氢,调节PH值为2,将锡离子以SnS沉淀而除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干.
(4)KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,Fe2+被氧化为Fe3+;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用碱式滴定管;
②依据滴定实验的反应终点时发生的反应进行计算.
(2)可用KSCN溶液检验铁离子的存在;
(3)由市售铁屑(含少量锡、氧化铁等杂质)为原料制备FeSO4?7H2O晶体,要弄清楚流程中每一步的原理和注意事项;向铁屑中加入足量的稀硫酸,Fe2O3、铁,少量锡均会与硫酸反应,最终生成二价铁、二价锡,先过滤除去不溶物,然后向滤液中加入稀硫酸和硫化氢,调节PH值为2,将锡离子以SnS沉淀而除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干.
(4)KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,Fe2+被氧化为Fe3+;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用碱式滴定管;
②依据滴定实验的反应终点时发生的反应进行计算.
解答:
解:(1)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(2)Fe3+遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明Fe3+的存在.因此取少量晶体溶于水,滴加KSCN溶液,若溶液变红,说明含有Fe3+,若溶液不变红,说明不含Fe3+,故答案为:取少量晶体溶于水,滴加KSCN溶液,若溶液变红,说明含有Fe3+,若溶液不变红,说明不含Fe3+;
(3)由市售铁屑(含少量锡、氧化铁等杂质)为原料制备FeSO4?7H2O晶体,要弄清楚流程中每一步的原理和注意事项;向铁屑中加入足量的稀硫酸,Fe2O3、铁,少量锡均会与硫酸反应,最终生成二价铁、二价锡,先过滤除去不溶物,然后向滤液中加入稀硫酸和硫化氢,调节PH值为2,将锡离子以SnS沉淀而除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干.故答案为:蒸发浓缩得到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,过滤,洗涤,低温烘干;
(4)KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,Fe2+被氧化为Fe3+,化学方程式为:2KMnO4+10FeSO4+8H2SO4═5Fe2(SO4)3+2MnSO4+1K2SO4+8H2O;故答案为:2 10 8 5 2 1 8;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用碱式滴定管,用酸式滴定管,
故答案为:碱; KMnO4有强氧化性,会腐蚀橡胶;
②5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×
=0.01mol;
FeSO4?7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=
×100%=0.75.
故答案为:0.75.
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(2)Fe3+遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明Fe3+的存在.因此取少量晶体溶于水,滴加KSCN溶液,若溶液变红,说明含有Fe3+,若溶液不变红,说明不含Fe3+,故答案为:取少量晶体溶于水,滴加KSCN溶液,若溶液变红,说明含有Fe3+,若溶液不变红,说明不含Fe3+;
(3)由市售铁屑(含少量锡、氧化铁等杂质)为原料制备FeSO4?7H2O晶体,要弄清楚流程中每一步的原理和注意事项;向铁屑中加入足量的稀硫酸,Fe2O3、铁,少量锡均会与硫酸反应,最终生成二价铁、二价锡,先过滤除去不溶物,然后向滤液中加入稀硫酸和硫化氢,调节PH值为2,将锡离子以SnS沉淀而除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干.故答案为:蒸发浓缩得到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,过滤,洗涤,低温烘干;
(4)KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,Fe2+被氧化为Fe3+,化学方程式为:2KMnO4+10FeSO4+8H2SO4═5Fe2(SO4)3+2MnSO4+1K2SO4+8H2O;故答案为:2 10 8 5 2 1 8;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用碱式滴定管,用酸式滴定管,
故答案为:碱; KMnO4有强氧化性,会腐蚀橡胶;
②5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×
| 250 |
| 25 |
FeSO4?7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=
| 2.78g |
| 3.72g |
故答案为:0.75.
点评:本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
我们生活在千变万化的物质世界里.下列变化中,没有发生氧化还原反应的是( )
| A、爆竹爆炸 | B、木炭燃烧 |
| C、蒸发 | D、电解水 |
下表中关于相关物质类型的描述全部正确的一组是( )
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 蔗糖 | Ba(OH)2 | CO2 |
| B | 聚乙烯 | 石膏 | CaCO3 | NH3 |
| C | 王水 | 冰 | H2SiO3 | Cl2 |
| D | 胆矾 | 玻璃 | H2SO3 | CH3CH2OH |
| A、A | B、B | C、C | D、D |
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
| A、Na和O2 |
| B、Ca(OH)2溶液和CO2 |
| C、Zn和稀硫酸 |
| D、AlCl3和NaOH |


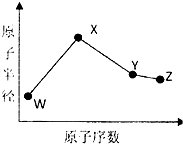 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.