题目内容
9.氯化铁和高铁酸钾都是常见的水处理剂,如图为制备粗高铁酸钾的工业流程.
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达)Fe3++3H2O?Fe(OH)3+3H+,水解产生的Fe(OH)3胶体能够吸附杂质.
(2)吸收剂X的化学式为FeCl2,氧化剂Y的化学式为NaClO.
(3)碱性条件下反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O.
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品.该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行.
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用B(填序号).
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率.
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点.以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式FeO42-3e-+4SO3═Fe3++4SO42-.
分析 氯气与铁反应生成三氯化铁,冷却得到三氯化铁固体,尾气中含有氯气,用氯化亚铁溶液吸收得到氯化铁溶液,把氯化铁固体溶于吸收液得到浓氯化铁溶液,氯气与氢氧化钠溶液反应生成次氯酸钠溶液,次氯酸钠具有强氧化性,与氯化铁溶液反应生成Na2FeO4,然后向该溶液中加饱和的KOH溶液,析出固体K2FeO4,
(1)氯化铁做净水剂是因为Fe3+水解为Fe(OH)3胶体的缘故;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂;
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(4)根据溶解度大小分析可知,在反应中溶解度小的物质先析出,会促进反应的进行;
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,所以用碱液来洗涤,抑制水解,不引入新的杂质所以用稀KOH溶液;异丙醇易挥发;
(6)依据原电池原理分析判断,负极上是发生氧化反应,正极上是得电子发生还原反应,高铁酸根离子被二氧化硫还原为铁离子,结合电解质溶液书写电极反应.
解答 解:(1)氯化铁做净水剂是因为Fe3+水解为Fe(OH)3胶体的缘故,原理为Fe3++3H2O?Fe(OH)3(胶体)+3H+,Fe(OH)3胶体能够吸附杂质;
故答案为:Fe3++3H2O?Fe(OH)3+3H+,水解产生的Fe(OH)3胶体能够吸附杂质;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂,所以Y为NaClO,
故答案为:FeCl2;NaClO;
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(4)该反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,反应能发生的原因是K2FeO4溶解度小,析出晶体,促进反应进行;
答案为:K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行;
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,所以用碱液来洗涤,抑制水解,不引入新的杂质所以用稀KOH溶液,高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
故答案为:B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
(6)以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,高铁酸根离子得到电子生成铁离子,用传导离子硫酸根离子配平电极反应,该电池正极电极反应式:FeO42-3e-+4SO3═Fe3++4SO42-;
故答案为:FeO42-3e-+4SO3═Fe3++4SO42-.
点评 本题考查了物质的制备流程的理解应用、实验基本操作、物质性质的分析应用、氧化还原反应、电化学等,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,熟练掌握基础是关键,题目难度中等.

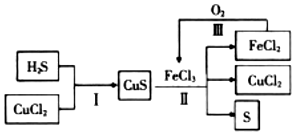
| A. | 在转化过程中化合价不变的元素只有Cu和Cl | |
| B. | 反应II中每生成1.25molS需要2.5molFeCl3 | |
| C. | 在转化过程中能循环利用的物质有FeCl2和CuCl2 | |
| D. | 反应Ⅲ中消耗1molO2时,可转化4mol的FeCl2 |
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |

| A. | 氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量 | |
| B. | 436kJ/mol是指断开1molH2 中的H-H键需要放出436kJ的能量 | |
| C. | 431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量 | |
| D. | 氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| 选项 | a | b | c | 试管②中现象 | 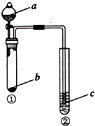 |
| A | NaOH溶液 | Al | 肥皂水 | 肥皂泡可点燃 | |
| B | 稀盐酸 | 碳酸钙 | NaAlO2溶液 | 生成白色絮状沉淀生成 | |
| C | 稀硫酸 | NaHCO3 | BaCl2溶液 | 溶液变浑浊 | |
| D | 水 | Na2O2 | 酸化的FeSO4溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |
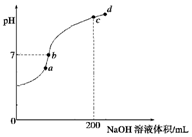 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②常温下,硫化钠水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子.
①常温下,NaHS溶液显碱性(选填“酸性”、“中性”或“碱性”)
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是c;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-).
③试解释工业上用可溶性铜盐作为沉淀剂除废水中少量NaHS溶液时,废水pH减小的原因Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小(写出必要的文字叙述和相关方程式)
(3)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有FeCl2;H2S(填化学式).
(4)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是副产氢气,生成的NaOH可循环利用.
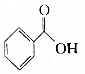
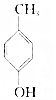
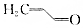 .则与键线式为
.则与键线式为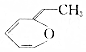 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )