题目内容
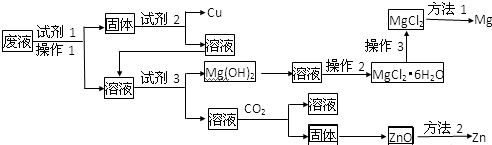
18.根据图中包含的信息分析,下列叙述正确的是( )
| A. | 氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量 | |
| B. | 436kJ/mol是指断开1molH2 中的H-H键需要放出436kJ的能量 | |
| C. | 431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量 | |
| D. | 氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量 |
分析 由图知:断开1molH2中的H-H键需要吸收436kJ的能量,生成1molHCl中的H-Cl键需要放出431kJ的能量,反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol,以此解答该题.
解答 解:A.反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol,故A错误
B.436kJ/mol是指断开1molH2中的H-H键需要吸收436kJ的能量,故B错误;
C.431kJ/mol是指生成1molHCl中的H-Cl键需要放出431kJ的能量,故C错误;
D.由A分析可知反应生成2mol氯化氢气体放出的热量:431kJ/mol×2mol-436kJ/mol-248kJ/mol=183kJ/mol,故D正确.
故选D.
点评 本题考查反应热与焓变知识,为高频考点,侧重考查学生的分析能力,题目难度不大,注意把握如何从键能角度计算反应热的问题.

练习册系列答案
相关题目
8. 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
①步骤I中所用稀HNO3稍过量的目的是将铁元素全部转化为Fe3+.
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
9.一定温度下,水存在H2O?H++OH-△H=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
6.在50mL 0.1mol/L Na2S 溶液中逐滴加入50mL 0.1mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是( )
| A. | c(SO42-)=c(HS-)=c(K+)>c(OH-)=c(H+) | |
| B. | c(Na+)>c(K+)>c(S2-)>c(H+)>c(OH-) | |
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S)+c(SO42-) | |
| D. | c(K+)+c(Na+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) |
13.研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域.自然界中碳循环如图所示:

(1)在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型有化合反应或氧化反应或裂解反应.
(2)光合作用是把无机物转化为有机物的同时,还能把光能转化为化学能.
(3)化石燃料最终转化为CO2,要使化石燃料充分燃烧,需测定煤或石油中的含碳量:将a g的样品进行充分燃烧,测定所得气体 ( CO2、SO2、NO2、N2、O2 ) 中CO2的含量.实验装置如图1所示 ( 所用试剂均过量 ):
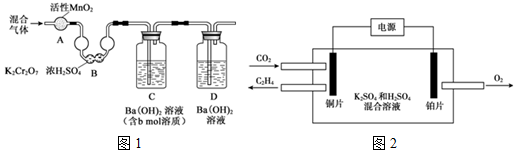
①混合气体通过A和B的目的是除去SO2、NO2,防止对Ba(OH)2吸收CO2造成干扰
②装置D的作用是防止空气中的CO2进入装置C,造成测碳量产生误差
③实验结束后,还需要向装置中通入N2,其目的是将装置A、B中的气体赶入装置C中,确保CO2被完全吸收.
④用x mol/L HCl溶液滴定装置C中过量的Ba(OH)2,消耗y mLHCl溶液,a g样品中碳元素的质量分数为$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%(列出计算式).
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见表. ( t1 <t2 <t3 )
①在15℃,用 NH3 的浓度变化表示 0~t1 时间段的反应速率为:$\frac{6×1{0}^{-3}}{{t}_{1}}$mol/(L•min)
②能证明该反应在t2时刻达到化学平衡的是a c(选填字母).
a.容器内压强不再变化 b.容器内 NH3、CO2物质的量比为 2:1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗NH3速率相等
(5)用一种钾盐的酸性水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图2).铂电极是阳(填“阴”或“阳”)极;在铜极上产生乙烯的电极反应式是2CO2+12H++12e -═C2H4+4H2O.

(1)在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型有化合反应或氧化反应或裂解反应.
(2)光合作用是把无机物转化为有机物的同时,还能把光能转化为化学能.
(3)化石燃料最终转化为CO2,要使化石燃料充分燃烧,需测定煤或石油中的含碳量:将a g的样品进行充分燃烧,测定所得气体 ( CO2、SO2、NO2、N2、O2 ) 中CO2的含量.实验装置如图1所示 ( 所用试剂均过量 ):

①混合气体通过A和B的目的是除去SO2、NO2,防止对Ba(OH)2吸收CO2造成干扰
②装置D的作用是防止空气中的CO2进入装置C,造成测碳量产生误差
③实验结束后,还需要向装置中通入N2,其目的是将装置A、B中的气体赶入装置C中,确保CO2被完全吸收.
④用x mol/L HCl溶液滴定装置C中过量的Ba(OH)2,消耗y mLHCl溶液,a g样品中碳元素的质量分数为$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%(列出计算式).
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见表. ( t1 <t2 <t3 )
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
②能证明该反应在t2时刻达到化学平衡的是a c(选填字母).
a.容器内压强不再变化 b.容器内 NH3、CO2物质的量比为 2:1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗NH3速率相等
(5)用一种钾盐的酸性水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图2).铂电极是阳(填“阴”或“阳”)极;在铜极上产生乙烯的电极反应式是2CO2+12H++12e -═C2H4+4H2O.
7.某校化学实验小组对电化学问题进行了如图所示实验探究.
探究一:探究弱酸性条件下铁发生电化学腐蚀类型的影响因素.将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中的压强随时间的变化如图(2)所示.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧 腐蚀,请在图(3)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生的电极反应式是O2+2H2O+4e-═4OH-.
(3)该小组对图(2)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
探究二:探究电解现象
利用图2装置做电解50mL 0.5mol•L-1CuCl2溶液的实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);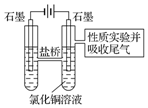
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(4))分析实验记录A中试纸颜色变化,用离子方程式解释:
①2I-+Cl2=I2+2Cl-;
②5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(5)分析实验记录B中浅蓝色固体可能是Cu(OH)2(写化学式),试分析生成该物质的原因(用必要的文字和化学用语解释)电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的PH增大,铜离子转化为氢氧化铜沉淀.
探究一:探究弱酸性条件下铁发生电化学腐蚀类型的影响因素.将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.

(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
(3)该小组对图(2)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
探究二:探究电解现象
利用图2装置做电解50mL 0.5mol•L-1CuCl2溶液的实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);

B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(4))分析实验记录A中试纸颜色变化,用离子方程式解释:
①2I-+Cl2=I2+2Cl-;
②5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(5)分析实验记录B中浅蓝色固体可能是Cu(OH)2(写化学式),试分析生成该物质的原因(用必要的文字和化学用语解释)电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的PH增大,铜离子转化为氢氧化铜沉淀.