题目内容
4.在配制一定物质的量浓度的溶液中,下列操作使得到的溶液浓度偏高、偏低还是无影响?(1)称好后的药品放入烧杯时,有少量洒在烧杯外.偏小
(2)未洗涤烧杯和玻璃棒2次~3次.偏小
(3)在定容时加水超过刻度线,再用胶头滴管吸出多余部分.偏小
(4)洗涤容量瓶后,未干燥,瓶中有少量蒸馏水.无影响.
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响分析误差,若n偏大或V偏小则浓度偏大,若n偏小或V偏大,则浓度偏小,以此来解答.
解答 解:(1)称好后的药品放入烧杯时,有少量洒在烧杯外,n偏小,由c=$\frac{n}{V}$可知,浓度偏小,故答案为:偏小;
(2)未洗涤烧杯和玻璃棒2次~3次,n偏小,由c=$\frac{n}{V}$可知,浓度偏小,故答案为:偏小;
(3)在定容时加水超过刻度线,再用胶头滴管吸出多余部分,V偏大,由c=$\frac{n}{V}$可知,浓度偏小,故答案为:偏小;
(4)洗涤容量瓶后,未干燥,瓶中有少量蒸馏水,n、V均无影响,则浓度无影响,故答案为:无影响.
点评 本题考查配制一定浓度的溶液,为高频考点,把握配制溶液的操作、浓度公式为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.

练习册系列答案
相关题目
15.已知:
2C(s)+O2(g)═2CO(g),△H=-220.6kJ•mol-1
2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ•mol-1
C(s)+H2O(g)═CO(g)+H2(g),△H=akJ•mol-1
则 a 为( )
2C(s)+O2(g)═2CO(g),△H=-220.6kJ•mol-1
2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ•mol-1
C(s)+H2O(g)═CO(g)+H2(g),△H=akJ•mol-1
则 a 为( )
| A. | ?263 | B. | +263 | C. | ?352.1 | D. | +131.5 |
13.研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域.自然界中碳循环如图所示:

(1)在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型有化合反应或氧化反应或裂解反应.
(2)光合作用是把无机物转化为有机物的同时,还能把光能转化为化学能.
(3)化石燃料最终转化为CO2,要使化石燃料充分燃烧,需测定煤或石油中的含碳量:将a g的样品进行充分燃烧,测定所得气体 ( CO2、SO2、NO2、N2、O2 ) 中CO2的含量.实验装置如图1所示 ( 所用试剂均过量 ):
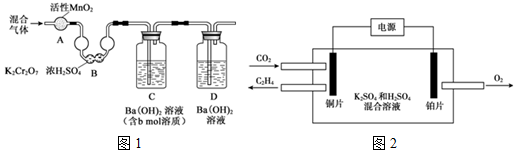
①混合气体通过A和B的目的是除去SO2、NO2,防止对Ba(OH)2吸收CO2造成干扰
②装置D的作用是防止空气中的CO2进入装置C,造成测碳量产生误差
③实验结束后,还需要向装置中通入N2,其目的是将装置A、B中的气体赶入装置C中,确保CO2被完全吸收.
④用x mol/L HCl溶液滴定装置C中过量的Ba(OH)2,消耗y mLHCl溶液,a g样品中碳元素的质量分数为$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%(列出计算式).
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见表. ( t1 <t2 <t3 )
①在15℃,用 NH3 的浓度变化表示 0~t1 时间段的反应速率为:$\frac{6×1{0}^{-3}}{{t}_{1}}$mol/(L•min)
②能证明该反应在t2时刻达到化学平衡的是a c(选填字母).
a.容器内压强不再变化 b.容器内 NH3、CO2物质的量比为 2:1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗NH3速率相等
(5)用一种钾盐的酸性水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图2).铂电极是阳(填“阴”或“阳”)极;在铜极上产生乙烯的电极反应式是2CO2+12H++12e -═C2H4+4H2O.

(1)在海洋中化石燃料转化为地质碳酸盐的过程中发生的反应类型有化合反应或氧化反应或裂解反应.
(2)光合作用是把无机物转化为有机物的同时,还能把光能转化为化学能.
(3)化石燃料最终转化为CO2,要使化石燃料充分燃烧,需测定煤或石油中的含碳量:将a g的样品进行充分燃烧,测定所得气体 ( CO2、SO2、NO2、N2、O2 ) 中CO2的含量.实验装置如图1所示 ( 所用试剂均过量 ):

①混合气体通过A和B的目的是除去SO2、NO2,防止对Ba(OH)2吸收CO2造成干扰
②装置D的作用是防止空气中的CO2进入装置C,造成测碳量产生误差
③实验结束后,还需要向装置中通入N2,其目的是将装置A、B中的气体赶入装置C中,确保CO2被完全吸收.
④用x mol/L HCl溶液滴定装置C中过量的Ba(OH)2,消耗y mLHCl溶液,a g样品中碳元素的质量分数为$\frac{(b-\frac{1}{2}xy×1{0}^{-3})×12}{a}$×100%(列出计算式).
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见表. ( t1 <t2 <t3 )
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
②能证明该反应在t2时刻达到化学平衡的是a c(选填字母).
a.容器内压强不再变化 b.容器内 NH3、CO2物质的量比为 2:1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗NH3速率相等
(5)用一种钾盐的酸性水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图2).铂电极是阳(填“阴”或“阳”)极;在铜极上产生乙烯的电极反应式是2CO2+12H++12e -═C2H4+4H2O.
20.在Al3++3H2O≒Al(OH)3+3H+的平衡体系中,要抑制Al3+的水解,可采取的措施为( )
| A. | 加热 | B. | 通入氯化氢气体 | ||
| C. | 加入适量的氢氧化钠溶液 | D. | 加入固体AlCl3 |
16.已知c(NH4Cl)≤0.1mol/L时,溶液pH>5.1.现用0.1mol/L盐酸滴定10mL 0.05mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为( )
| A. | 10 mL | B. | 5 mL | C. | 大于5 mL | D. | 小于5 mL |
13.关于容量瓶的使用,下列操作正确的是( )
| A. | 使用前要先检查容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了方便快捷,可以直接在容量瓶内进行固体溶解 | |
| D. | 定容结束后,为了使溶液均匀,手握瓶颈,左右振荡 |
14.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?Y(g)+Z(s),不是反应达到平衡标志的是( )
| A. | 混合气体的压强不再变化 | B. | X、Y、Z的物质的量之比为2:1:1 | ||
| C. | 混合气体的密度不再变化 | D. | X的分解速率是Y的分解速率的两倍 |
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)