题目内容
19. 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②常温下,硫化钠水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子.
①常温下,NaHS溶液显碱性(选填“酸性”、“中性”或“碱性”)
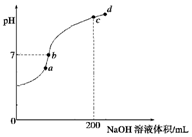
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是c;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-).
③试解释工业上用可溶性铜盐作为沉淀剂除废水中少量NaHS溶液时,废水pH减小的原因Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小(写出必要的文字叙述和相关方程式)
(3)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有FeCl2;H2S(填化学式).
(4)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是副产氢气,生成的NaOH可循环利用.
分析 (1)①电离常数越小,对应的盐溶液的碱性越强;
②S2-在溶液中存在两步水解;
(2)①HS-在溶液中的水解程度大于电离程度;
②当H2S与NaOH恰好反应生成Na2S时,溶液中水的电离程度最大;在b点溶液显中性,结合电荷守恒分析;
③可溶性铜盐与NaHS溶液反应生成CuS沉淀,结合离子方程式分析;
(3)黑色的Fe2S3固体加入足量的盐酸中,溶液中有淡黄色固体生成,淡黄色固体为S,可知S元素的化合价升高,则Fe元素的化合价降低;
(4)类比电解氯化钠饱和溶液的电解反应,写出电解硫化钠溶液的电解反应方程式,根据产物来说明反应的优点.
解答 解:(1)①电离常数越小,酸的酸性越弱,对应的盐溶液的碱性越强,硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子,所以硫化钠溶液的碱性强于碳酸钠溶液;
故答案为:硫化钠溶液;硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子;
②S2-在溶液中存在两步水解,水解的离子方程式为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)①HS-在溶液中的水解程度大于电离程度,所以常温下,NaHS溶液显碱性;
故答案为:碱性;
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,当H2S与NaOH恰好反应生成Na2S时,溶液中水的电离程度最大,c点氢氧化钠的体积为20mL,H2S与NaOH恰好反应,所以c点水的电离程度最大;在b点溶液显中性c(OH-)=c(H+),溶液中电荷守恒为:c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-),溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-);
故答案为:c;c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-);
③可溶性铜盐与NaHS溶液反应生成CuS沉淀,反应的离子方程式为Cu2++HS-=H++CuS↓;
故答案为:Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小;
(3)黑色的Fe2S3固体加入足量的盐酸中,溶液中有淡黄色固体生成,淡黄色固体为S,可知S元素的化合价升高,则Fe元素的化合价降低,结合H、Cl元素守恒可知,反应产物还有氯化亚铁、硫化氢,
故答案为:FeCl2;H2S;
(4)电解硫化钠溶液的电解反应方程式为:Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH,根据反应方程式可以得出:产物除硫单质外,还有H2和NaOH生成,所以该过程的优点是:副产物是氢气,生成的NaOH可循环利用;
故答案为:Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;副产氢气,生成的NaOH可循环利用.
点评 本题考查了弱电解质的电离、盐类的水解和离子浓度大小的比较、酸碱混合的定性判断,题目难度中等,注意根据守恒思想解题,注意把握反应的先后顺序为解答的关键,涉及盐类的水解和离子浓度大小的比较,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | FeCl2 | B. | FeCl3 | C. | Na2S | D. | Fe3O4 |
探究一:探究弱酸性条件下铁发生电化学腐蚀类型的影响因素.将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.

(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
(3)该小组对图(2)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
探究二:探究电解现象
利用图2装置做电解50mL 0.5mol•L-1CuCl2溶液的实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
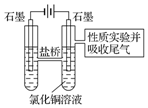
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(4))分析实验记录A中试纸颜色变化,用离子方程式解释:
①2I-+Cl2=I2+2Cl-;
②5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(5)分析实验记录B中浅蓝色固体可能是Cu(OH)2(写化学式),试分析生成该物质的原因(用必要的文字和化学用语解释)电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的PH增大,铜离子转化为氢氧化铜沉淀.
| A. | 混合气体的压强不再变化 | B. | X、Y、Z的物质的量之比为2:1:1 | ||
| C. | 混合气体的密度不再变化 | D. | X的分解速率是Y的分解速率的两倍 |
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2S ⑧FeCl3.
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑦⑧ | D. | ②③⑤⑥⑦⑧ |
| A. | 变小 | B. | 变大 | C. | 不变 | D. | 无法确定 |
