题目内容
18.某实验小组探究少量Cl2和FeBr2反应的过程.(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色.取少量此溶液,向其中滴入KSCN溶液,变为浅红色.
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是烧杯、玻璃棒、50mL容量瓶、胶头滴管.
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有Fe3+,用离子方程式解释产生其原因:4Fe2++O2+4H+=4Fe3++2H2O.
(2)氯气和FeBr2反应实验操作及现象如图1:
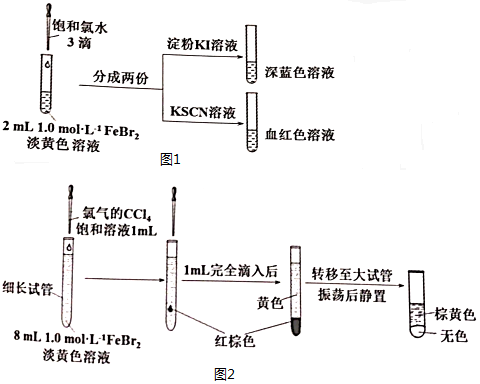
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应.
①Cl2和Fe2+发生反应的离子方程式是Cl2+2Fe2+=2C1-+2Fe3+.
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝.
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象.乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应.乙得出该结论依据的实验现象是静置后,上层溶液为黄色,下层溶液无色.
(3)丙同学继续设计实验如图2,探究反应过程:
①转移到大试管前CCl4液体中呈红棕色的物质是Br2.
②丙通过此实验可得出结论:少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+.
分析 (1)①配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶,配制50mL1.0mol/LFeBr2溶液,用到的玻璃仪器有:烧杯、玻璃棒、50mL容量瓶、胶头滴管;
②黄色为铁离子颜色,亚铁离子易被空气中的氧气氧化成铁离子;
(2)①Cl2具有强氧化性,可使Fe2+转化为Fe3+,自身被还原生成氯离子;
②铁离子具有氧化性、碘离子具有还原性,二者发生氧化还原反应生成亚铁离子和碘单质;
③少量Cl2与Fe2+反应,若继续氧化铁离子,则加入CCl4萃取后,下层为紫色,上层为黄色;
(3)①溴单质为深红棕色;
②丙通过此少量Cl2能与Br-反应,发现生成的Br2会继续氧化溶液中的Fe2+.
解答 解:(1)①配制50mL1.0mol/LFeBr2溶液,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到50mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,因配制50mL溶液,则需选用50mL容量瓶,最后需胶头滴管定容,所以所需玻璃仪器为:烧杯、玻璃棒、50mL容量瓶、胶头滴管,
故答案为:烧杯、玻璃棒、50mL容量瓶、胶头滴管;
②FeBr2溶液呈黄色,是因为含有铁离子,因亚铁离子具有还原性,易被空气中的氧气氧化,反应离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:Fe3+;4Fe2++O2+4H+=4Fe3++2H2O;
(2)①Cl2具有强氧化性,可使Fe2+转化为Fe3+,自身被还原生成氯离子,离子方程式为:Cl2+2Fe2+=2C1-+2Fe3+,
故答案为:Cl2+2Fe2+=2C1-+2Fe3+;
②铁离子具有氧化性、碘离子具有还原性,溶液中含有的Fe3+可与I-反应,二者发生氧化还原反应生成亚铁离子和碘单质,离子方程式为2Fe3++2I-=2Fe 2++I2,I2使淀粉变蓝,
故答案为:溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝;
③少量Cl2与Fe2+反应,加入CCl4萃取后,静置后,上层溶液为黄色,为铁离子,下层溶液无色,说明不含有溴,因溴单质在四氯化碳中呈现紫色,
故答案为:静置后,上层溶液为黄色,下层溶液无色;
(3)①转移到大试管前CCl4液体中呈红棕色,为溴单质,
故答案为:Br2;
②丙同学,向其中滴加饱和氯水后,转移到大试管前CCl4液体中呈红棕色为溴单质,少量Cl2能与Br-反应,生成的Br2,再转移到大试管震荡静置,上层棕黄色为铁离子,说明生成的Br2会继续氧化溶液中的Fe2+,
故答案为:少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+.
点评 本题考查Cl2和FeBr2反应的过程实验探究,掌握氯、铁、溴的性质以及明确溶液中离子反应的先后顺序是解答关键,试题培养了学生的分析问题和解决问题的能力,题目难度中等.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案| A. | 在常温常压下,C4H10是液体 | |
| B. | 丁烷有正丁烷与异丁烷两种同分异构体 | |
| C. | C4H10与C9H20互为同系物 | |
| D. | C4H10进行一氯取代后共生成两种沸点不同的产物 |
| A. | 甲、乙两杯溶液的物质的量浓度之间的关系为c(甲)=10c(乙) | |
| B. | 甲溶液中醋酸的电离程度小 | |
| C. | 中和等物质的量的NaOH,需要乙的体积是甲的10倍 | |
| D. | 甲乙等体积,与足量锌反应时,乙产生氢气的物质的量大 |
 最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2═2Na2CO3+C.下列说法错误的是( )
最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2═2Na2CO3+C.下列说法错误的是( )| A. | 电池工作温度可能在200℃以上 | |
| B. | 充电时,钠箔与外接电源的负极相连 | |
| C. | 该电池放电时吸收二氧化碳,充电时放出二氧化碳 | |
| D. | 放电时,正极的电极反应为:4Na++3CO2+4e-═2Na2CO3+C |
| A. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 在含有等物质的量的OH-、CO32-、SO32-的溶液中加入稀盐酸:OH-、SO32-、CO32- | |
| C. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ | |
| D. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 |
| A. | 体现浓硫酸的吸水性 | |
| B. | 体现了浓硫酸的脱水性 | |
| C. | 体现了浓硫酸的吸水性和脱水性 | |
| D. | 体现了浓硫酸的吸水性、脱水性和强氧化性 |
