题目内容
6.25℃时有甲、乙两杯醋酸溶液,甲的pH=2,乙的pH=3,下列判断正确的是( )| A. | 甲、乙两杯溶液的物质的量浓度之间的关系为c(甲)=10c(乙) | |
| B. | 甲溶液中醋酸的电离程度小 | |
| C. | 中和等物质的量的NaOH,需要乙的体积是甲的10倍 | |
| D. | 甲乙等体积,与足量锌反应时,乙产生氢气的物质的量大 |
分析 醋酸为弱电解质,浓度越大,电离程度越小,甲的pH=2,乙的pH=3,则甲的浓度应大于乙的10倍,以此解答该题.
解答 解:A.酸的浓度越大,酸的电离程度越小,c(甲)>10c(乙),故A错误;
B.甲的浓度较大,浓度越大,电离程度越小,故B正确;
C.弱酸的浓度越大,酸的电离程度越小,醋酸与等量NaOH反应,醋酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗醋酸的体积,10V(甲)<V(乙),故C错误;
D.甲的浓度较大,完全反应生成氢气的体积较大,故D错误.
故选B.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生的分析能力,注意弱电解质的电离程度和浓度的关系是解答本题的关键,题目难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
16.已知25℃时有关弱酸的电离平衡常数如表:下列推断正确的是( )
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | pH相同的HX、HY溶液,HY的物质的量浓度小 | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:Y->CO32->X->HCO3- | |
| D. | 向NaX溶液中通入CO2的化学方程式:2NaX+CO2+H2O=Na2CO3+2HX |
17.下列变化不可能通过一步反应直接完成的是( )
| A. | Al(OH)3→Al2O3 | B. | SiO2→H2SiO3 | C. | Al→AlO2- | D. | Si→Na2SiO3 |
14.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在,Na+可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
1.下列关于油脂的叙述正确的是( )
| A. | 油脂均为固体 | |
| B. | 油脂在体内直接氧化产生热量 | |
| C. | 多吃动物脂肪比多吃植物油有利 | |
| D. | 有些脂肪酸是人体必需的,但在人体内却不能合成;脂肪中必需脂肪酸的含量越高,其营养价值越高 |
11.下列关于有机化合物的说法正确的是( )
| A. | C3H6和C4H8互为同系物 | |
| B. | CH2Cl2有2种同分异构体 | |
| C. | 苯乙烯分子中的所有原子不可能处于同一个平面 | |
| D. | 乙酸与乙醇的酯化反应是可逆反应 |
16.纤维分天然纤维和化学纤维,化学纤维又可分为合成纤维和人造纤维,下列材料中,主要成分属于合成纤维的是( )
①纯棉②涤纶③人造羊毛④黏胶纤维⑤醋酸纤维⑥羊毛.
①纯棉②涤纶③人造羊毛④黏胶纤维⑤醋酸纤维⑥羊毛.
| A. | ①②⑥ | B. | ③⑥ | C. | ②③ | D. | ①②③④⑤⑥ |
17.(Ⅰ)部分弱酸的电离平衡常数如表:
(1)室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为③②④①.
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O=HCO3-+HClO.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.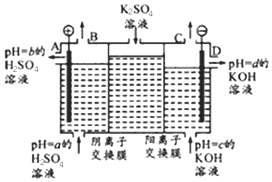
①该电解槽中通过阴离子交换膜的离子数<(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为b<a<c<d;
③电解一段时间后,B出口与C出口产生气体的质量比为8:1.
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O=HCO3-+HClO.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.

①该电解槽中通过阴离子交换膜的离子数<(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为b<a<c<d;
③电解一段时间后,B出口与C出口产生气体的质量比为8:1.