题目内容
8.某无色试样溶液可能含有以下离子中的一种或几种:K+、Mg2+、Al3+、Cu2+、SO42-、Cl-.现进行如下实验:①取少量该试样溶液加入过量的氢氧化钡溶液,充分反应后过滤,得到沉淀1和溶液1.
②向沉淀1中加入过量盐酸,沉淀部分溶解.
③向溶液1中通入适量二氧化碳气体,充分反应后过滤,得到沉淀2和溶液2.
④向沉淀2中加入过量盐酸,沉淀溶解并放出气体.
⑤另取少量该试样溶液进行焰色反应实验,透过蓝色钴玻璃片观察到紫色火焰.
(1)该试样溶液中肯定存在的离子有K+Mg2+SO42-.
(2)该试样溶液中可能存在的离子有Al3+、Cl-.
(3)该试样溶液中一定不存在的离子有Cu2+.
分析 无色溶液可知一定不含Cu2+,
①取少量该试样溶液加入过量的氢氧化钡溶液,充分反应后过滤,得到沉淀1和溶液1,沉淀1为硫酸钡或氢氧化镁;
②向沉淀1中加入过量盐酸,沉淀部分溶解,则沉淀1为硫酸钡和氢氧化镁,原溶液中一定含Mg2+、SO42-;.
③向溶液1中通入适量二氧化碳气体,充分反应后过滤,得到沉淀2和溶液2,则溶液1中含过量氢氧化钡,沉淀2可能为碳酸钡;
④向沉淀2中加入过量盐酸,沉淀溶解并放出气体,则沉淀2中碳酸钡可完全溶解生成气体,且沉淀2可能含氢氧化铝;
⑤另取少量该试样溶液进行焰色反应实验,透过蓝色钴玻璃片观察到紫色火焰,可知原溶液一定含K+,以此来解答.
解答 解:(1)由上述分析可知,原溶液中一定含K+ Mg2+ SO42-,故答案为:K+ Mg2+ SO42-;
(2)由上述分析可知,不能确定的离子为Al3+、Cl-,故答案为:Al3+、Cl-;
(3)该试样溶液中一定不存在的离子有Cu2+,故答案为:Cu2+.
点评 本题考查常见离子的推断,为高频考点,把握离子之间的反应、现象为解答的关键,侧重分析与推断能力的考查,注意氢氧化钡、盐酸均过量,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.配制一定量浓度的NaOH溶液,下列操作正确的是( )
| A. | 称量时,将NaOH固体放在右盘,砝码放在左盘 | |
| B. | 将NaOH固体在烧杯中溶解,所得的溶液冷却至室温后,再转移到容量瓶中 | |
| C. | 转移液体时,可以不用将洗涤液转至容量瓶 | |
| D. | 定容时,可以俯视刻度线读数 |
19.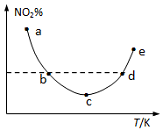 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )
 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )| A. | 图中a、b两点对应的反应未达到平衡状态 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | 该反应为吸热反应 | |
| D. | e点对应的容器中气体颜色最深 |
16.已知25℃时有关弱酸的电离平衡常数如表:下列推断正确的是( )
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | pH相同的HX、HY溶液,HY的物质的量浓度小 | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:Y->CO32->X->HCO3- | |
| D. | 向NaX溶液中通入CO2的化学方程式:2NaX+CO2+H2O=Na2CO3+2HX |
3.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法不正确的是( )
| A. | W、Y、R的简单离子半径依次增大 | |
| B. | X、R、Z都可与Y形成两种化合物 | |
| C. | X2Y的热稳定性强于X2R、沸点也高于X2R,但解释的理由不相同 | |
| D. | Z元素分别与X元素和Y元素形成的化合物都是离子晶体,均能与水反应且一定生成了强碱和无色气体 |
20.下列关于氯气的叙述正确的是( )
| A. | 钠在氯气中燃烧产生白色烟雾 | |
| B. | 红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾 | |
| C. | 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰 | |
| D. | 氯气可用于漂白,这是氯气的漂白作用 |
17.下列变化不可能通过一步反应直接完成的是( )
| A. | Al(OH)3→Al2O3 | B. | SiO2→H2SiO3 | C. | Al→AlO2- | D. | Si→Na2SiO3 |