题目内容
13.有A、B、C、D、E五种短周期元素,其元素特征信息如表:回答下列问题:| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物M的电子式
 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用氢键来解释.
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:H-Cl、H-O-O-H.
(5)D单质与M的水溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
分析 A、B、C、D、E短周期五种元素.A是其单质是密度最小的物质,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;B为氧元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为铝元素;E与C同周期,其原子半径在该周期最小,则E为氯元素,据此进行解答.
解答 解:A、B、C、D、E短周期五种元素.A是其单质是密度最小的物质,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;B为氧元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为铝元素;E与C同周期,其原子半径在该周期最小,则E为氯元素,
(1)由分析可知,C为钠元素;E为氯元素,
故答案为:钠;氯;
(2)H、O、Na组成的化合物M为NaOH,氢氧化钠为离子化合物,其电子式为 ,
,
故答案为: ;
;
(3)ACl3 在熔融状态下不导电,则AlCl3 属于共价化合物,含有共价键;B为O元素,其氢化物为水,水分子之间存在氢键,导致其沸点较高,
故答案为:共价键;氢键;
(4)由H、O、Na、Al、Cl五种元素中的两种形成的18电子体的化合物有HCl、H2O2等,HCl的结构式为:H-Cl,H2O2的结构式为:H-O-O-H,
故答案为:H-Cl、H-O-O-H;
(5)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题以元素推断为载体,考查元素化合物性质、原子结构位置与周期律关系、化学用语等知识,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4 mol硫被氧化 | |
| D. | 每转移1.2 mol电子,有0.3 mol硫被氧化 |
实验室有下列仪器:铁架台、启普发生器、量筒、烧杯、橡皮管、玻璃导管、分液漏斗.
已知下表中各物质在常温时的溶解度(g/100g水)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号)除①外,还需要④⑤.
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略)①量取一定量的NaOH溶液,分成两等份②制取CO2,向其中一份NaOH溶液中通入过量的CO2气体③将两溶液混合均匀.
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中会有晶体析出(写出计算步骤和必要的文字说明)
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,就加待测液
③滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
④滴定后俯视滴定管读数读取NaOH溶液的体积.
| A. | ②③ | B. | ①③ | C. | ①④ | D. | ③④ |
| A. | 乙醇、乙酸和乙酸乙酯可用饱和Na2CO3溶液鉴别 | |
| B. | 除去乙烷中少量的乙烯,可在光照条件下通入Cl2 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、纤维素、油脂都是高分子化合物 |
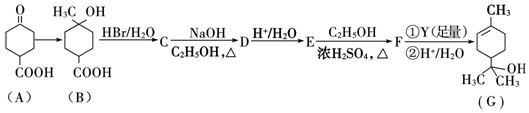
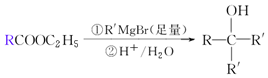
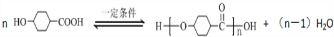 .
. .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.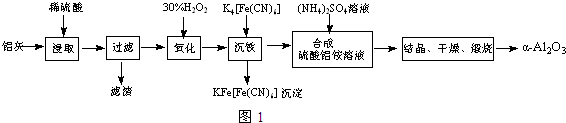
 (2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.
(2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.