题目内容
3.分析实验中出现下列现象对所配溶液的浓度有何影响:①浓硫酸溶解后未冷却至室温即转移至容量瓶中进行定容,偏高(填“偏高”、“偏低”或“无影响”);
②定容时仰视刻度线,偏低;填“偏高”、“偏低”或“无影响”);
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2~3次,将洗涤液倒入烧杯中,偏高.(填“偏高”、“偏低”或“无影响”);
(3)7.8g镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的数目为0.8NA,镁和铝分别产生氢气的体积之比为1:3.
分析 ①②③分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(3)令7.8g镁铝合金中Mg的物质的量为xmol,Al的物质的量为ymol,根据金属的质量、氢气的体积列方程,计算解答,依据消耗镁、铝的物质的量计算转移电子数;
解答 解:①浓硫酸溶解后未冷却至室温即转移至容量瓶中进行定容,冷却后溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
②定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2~3次,将洗涤液倒入烧杯中,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高;
故答案为:偏高;
(3)令7.8g镁铝合金中Mg的物质的量为xmol,Al的物质的量为ymol,则:24x+27y=7.8,
生成氢气的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,根据电子转移守恒有:2x+3y=0.4×2,
联立方程,解得:x=0.1,y=0.2;
设转移电子数为n则:
2H+~H2↑~2e-
1 2
0.4mol n
解得n=0.8mol;
所以转移电子数为0.8NA;
依据镁、铝与盐酸反应生成气体关系得;
Mg~H2↑ Al~1.5H2↑
1 1 1 1.5
0.1mol 0.1mol 0.2mol 0.3mol
所以镁与铝与盐酸反应生成氢气的体积之比等于物质的量之比等于:0.1:0.3=1:3;
故答案为:0.8NA;1:3;
点评 本题考查了有关方程式的计算,明确发生反应的实质,熟悉以物质的量为核心的计算公式是解题关键,题目难度不大.

| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物M的电子式
 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用氢键来解释.
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:H-Cl、H-O-O-H.
(5)D单质与M的水溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
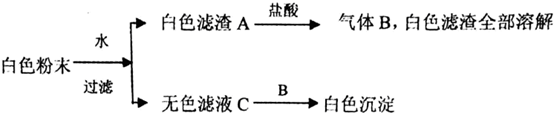
| A. | BaCl2,CaCO3一定存在,NaOH可能存在 | |
| B. | K2SO4、CuSO4一定不存在 | |
| C. | K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在 | |
| D. | C为单一溶质溶液 |
| A. | ②④⑤①③⑥ | B. | ⑤④②①③⑥ | C. | ⑤④②③①⑥ | D. | ②④⑤③①⑥ |
| A. | CH2O | B. | C3H6O3 | C. | C3H8O3 | D. | C3H6O2 |
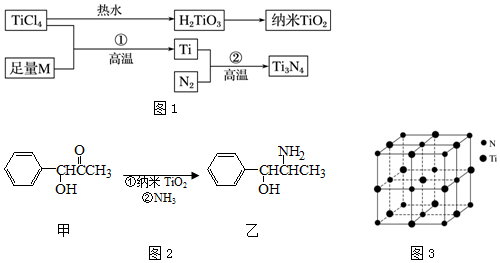
图中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为3d24s2.
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12.
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{{N_A}×(2a×{{10}^{-10}}{)^3}}}$g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12.
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
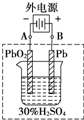 铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):