题目内容
一定浓度l00mL的HNO3溶液中加入2.8g Fe,全部溶解,得到标准状况下的NO气体1.12L,测得反应后溶液中的c(H+)=0.1mol/L.若反应前后溶液体积变化忽略不计,则下列有关判断错误的是( )
| A、反应后溶液中无硝酸亚铁 |
| B、反应前HNO3溶液的浓度为2.0mol?L-1 |
| C、反应后溶液中c(NO3-)=1.6mol?L-1 |
| D、反应后的溶液最多还能溶解1.61g Fe |
考点:化学方程式的有关计算
专题:计算题
分析:n(Fe)=
=0.05mol,n(NO)=
=0.05mol,反应后溶液中的c(H+)=0.1mol/L,说明溶液中硝酸过量,
A.少量铁和稀硝酸反应生成硝酸铁;
B.根据氮原子守恒计算原溶液中硝酸的浓度;
C.根据电荷守恒确定硝酸根离子浓度;
D.反应后的溶液中硝酸与硝酸铁中含NO3-,结合3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算最多消耗的Fe.
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4L/mol |
A.少量铁和稀硝酸反应生成硝酸铁;
B.根据氮原子守恒计算原溶液中硝酸的浓度;
C.根据电荷守恒确定硝酸根离子浓度;
D.反应后的溶液中硝酸与硝酸铁中含NO3-,结合3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算最多消耗的Fe.
解答:
解:n(Fe)=
=0.05mol,n(NO)=
=0.05mol,反应后溶液中的c(H+)=0.1mol/L,说明溶液中硝酸过量,
A.铁和过量硝酸反应生成硝酸铁,故A正确;
B.根据氮原子守恒得原溶液中n(HNO3)=n(NO)+3n[Fe(NO3)3]+n(HNO3) (剩余)=0.05mol+3×0.05mol+0.1mol/L×0.1L=0.21mol,
则原来硝酸的浓度=
=2.1mol/L,故B错误;
C.根据电荷守恒得c(NO3-)=3c(Fe3+)+c(H+)=3×
+0.1mol/L=1.6mol/L,故C正确;
D.原硝酸的物质的量=0.21mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.21mol×
×56=4.41g,则还能溶解4.41g-2.8=1.61g,故D正确,
故选B.
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4L/mol |
A.铁和过量硝酸反应生成硝酸铁,故A正确;
B.根据氮原子守恒得原溶液中n(HNO3)=n(NO)+3n[Fe(NO3)3]+n(HNO3) (剩余)=0.05mol+3×0.05mol+0.1mol/L×0.1L=0.21mol,
则原来硝酸的浓度=
| 0.21mol |
| 0.1L |
C.根据电荷守恒得c(NO3-)=3c(Fe3+)+c(H+)=3×
| 0.05mol |
| 0.1L |
D.原硝酸的物质的量=0.21mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.21mol×
| 3 |
| 8 |
故选B.
点评:本题考查氧化还原反应的计算,明确硝酸剩余发生的化学反应及最多溶解铁发生的化学反应是解答本题的关键,注意利用原子守恒计算原来硝酸浓度,选项D为解答的难点,题目难度中等.

练习册系列答案
相关题目
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、78 g Na2O2中含有的阴离子数为2NA |
| B、1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
下列各组离子中,在给定条件下能够大量共存的是( )
| A、通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | ||
| B、无色溶液中:Mg2+、MnO4-、SO42-、K+ | ||
C、
| ||
| D、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1mol/L的 NaHCO3溶液中:c (Na+)+c (H+)+C(H2CO3)=c (HCO3-)+c(CO32-)+c (OH-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>C(HX)>C(X-)>C(H+)>C(OH-) |
| C、在纯碱溶液中存在:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) |
| D、0.1mol/L HCOOH溶液中:C(HCOO-)+C(OH-)=C(H+) |
下列说法正确的是( )
| A、32g18O2中含有的氧原子数是2×6.02×1023 |
| B、1molN2和CO的混合气体中含有的分子总数是2×6.02×1023 |
| C、2.3gNa与O2完全反应生成3.6g产物时失电子数是0.1×6.02×1023 |
| D、1.0L0.1mol?L-1的NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |
甲醛(CH2O)、乙酸(C2H4O2)、和丙酸(C3H6O2)组成的混合物中,氧元素的质量分数为44%,则碳元素的质量分数为( )
| A、44% | B、48% |
| C、56% | D、无法计算 |
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向2L正庚烷中加入(t-BuNO)2 1.0mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2L).下列说法正确的是( )
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示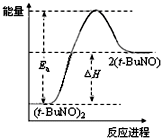 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
