题目内容
14.已知 2g H2 完全燃烧生成水蒸气时放出 242kJ 热量,1mol O2 中的化学键完全断裂时吸收 496kJ 热量,1mol H2 中 H-H 键完全断裂时吸收 436kJ 热量,则水蒸气中 1mol H-O 键形成时放出 热量为( )| A. | 926kJ | B. | 463 kJ | C. | 402.5kJ | D. | 23115 kJ |
分析 根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,结合反应方程式进行计算.
解答 解:已知2g氢气完全燃烧生成水蒸气时放出热量242kJ,则2mol氢气完全燃烧生成水蒸气时放出热量484kJ,
设水蒸气中1mol H-O键形成时放出热量xKJ,
化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知:484kJ=4x-(436kJ×2+496KJ),
解得x=463KJ,
故选B.
点评 本题考查学生化学反应中的能量变化知识,题目难度不大,注意根据反应热与键能的关系计算,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A. | KCl | B. | NaOH | C. | CuSO4 | D. | Na2SO4 |
 I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中:
I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中: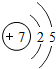 .
.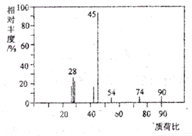 有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2. 如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题: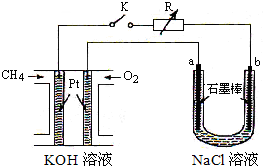 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.


