题目内容
8.化学与社会、科学、技术、环保密切相关.下列有关说法不正确的是( )| A. | 荧光蛋白是一种高分子化合物且能发生水解 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 利用次氯酸钠溶液的碱性对餐具和环境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等会形成雾霾 |
分析 A.荧光蛋白是一种高分子化合物,含-CONH-;
B.纯碱与硫酸钙发生沉淀的转化,生成碳酸钙可溶于盐酸;
C.NaClO溶液具有强氧化性;
D.大量排放PM2.5、SO2、NOX等,污染空气.
解答 解:A.荧光蛋白是一种高分子化合物,含-CONH-,可发生水解反应,故A正确;
B.纯碱与硫酸钙发生沉淀的转化,生成碳酸钙可溶于盐酸,则用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙,故B正确;
C.NaClO溶液具有强氧化性,对餐具和环境消毒,与碱性无关,故C错误;
D.大量排放PM2.5、SO2、NOX等,污染空气,会形成雾霾,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、组成及发生的反应、环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
18.下列化学式所代表的物质一定是纯净物的是( )
| A. | C2H6O | B. | CH2Cl2 | C. | C2H4Cl2 | D. | C2H4O2 |
19.下列各种关于酸的使用,其中正确的是( )
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
16.Na2SO3应用广泛.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下.
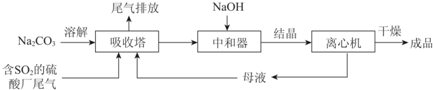
(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
(2)图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.
(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的.
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s) 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
②结晶时应选择的最佳操作是b(选填字母).
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:1IO3-+3SO32-=3SO42-+1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.

(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
(2)图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.

(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s)
 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.②结晶时应选择的最佳操作是b(选填字母).
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:1IO3-+3SO32-=3SO42-+1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.
3.酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-.已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10. 下列说法正确的是( )
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
13.下列物质中,属于纯净物的是( )
| A. | 水泥 | B. | 漂白粉 | C. | 胆矾 | D. | 氯水 |
20.质量反应的离子方程式书写正确的是( )
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
18.西维因(结构简式为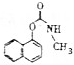 )在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(
)在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(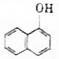 )合成西维因的反应:
)合成西维因的反应:
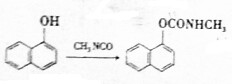
下列说法正确的是( )
 )在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(
)在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚( )合成西维因的反应:
)合成西维因的反应:
下列说法正确的是( )
| A. | 该反应为加成反应 | |
| B. | 可用FeCl3溶液检验萘酚是否完全反应 | |
| C. | 萘酚与苯酚互为同系物 | |
| D. | 1mol西维因最多能与2molNaOH反应 |
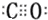 .
.