题目内容
3.酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-.已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10. 下列说法正确的是( )| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
分析 A.冰醋酸中H2SO4发生部分电离;
B.根据溶液中质子守恒分析;
C.在冰醋酸中的酸的电离平衡常数越大,电离出的氢离子浓度越大,pH越小;
D.向HNO3的冰醋酸溶液中加入冰醋酸,c(NO3-)减小,结合电离平衡常数分析.
解答 解:A.冰醋酸中H2SO4发生部分电离,分步电离,以第一步电离为主,则冰醋酸中H2SO4的电离方程式:H2SO4+CH3COOH?HSO4-+CH3COOH2+,故A错误;
B.H2SO4的冰醋酸溶液中存在质子守恒:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-),故B正确;
C.在冰醋酸中的酸的电离平衡常数越大,电离出的氢离子浓度越大,pH越小,硫酸的电离常数大,所以H2SO4中氢离子浓度大,则pH(H2SO4)<pH(HNO3),故C错误;
D.向HNO3的冰醋酸溶液中加入冰醋酸,溶液的体积增大,则c(NO3-)减小,电离常数为$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})c(N{{O}_{3}}^{-})}{c(HN{O}_{3})}$是常数,所以$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$增大,故D错误.
故选B.
点评 本题考查了弱电解质的电离,题目难度中等,侧重于考查学生的分析能力,注意根据题干中的信息分析,明确弱电解质的电离平衡和电离常数的含义即可解答.

练习册系列答案
相关题目
11.依据元素周期律进行推断,下列不正确的是( )
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
18.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
8.化学与社会、科学、技术、环保密切相关.下列有关说法不正确的是( )
| A. | 荧光蛋白是一种高分子化合物且能发生水解 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 利用次氯酸钠溶液的碱性对餐具和环境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等会形成雾霾 |
15.同温同压下,相同质量的下列气体中,体积最大的是( )
| A. | N2 | B. | SO2 | C. | Cl2 | D. | CO2 |
13.下列有关乙烯的说法,其中错误的是( )
| A. | 乙烯分子的双键中有一键较易断裂 | |
| B. | 烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷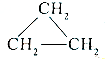 的分子组成符合通式CnH2n,因此它们属于同系物 的分子组成符合通式CnH2n,因此它们属于同系物 |

 .
. .
.