题目内容
17.完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式CH3CH2CH2CH3 或CH(CH3)3.分析 浓硫酸增重为燃烧生成水的质量,浓碱液增重为燃烧生成二氧化碳的质量,计算水、二氧化碳的物质的量,根据原子守恒计算烃的分子式,书写可能的结构简式.
解答 解:浓硫酸增重9g为水的质量,浓碱液增重17.6g为二氧化碳的质量,
则n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,n(H)=1mol,则1mol烃中含有10molH原子,
n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,n(C)=0.4mol,则1mol烃中含有4molC原子,
所以该烃的分子式为C4H10,可能的结构简式为:CH3CH2CH2CH3 或CH(CH3)3,
故答案为:C4H10;CH3CH2CH2CH3 或CH(CH3)3.
点评 本题考查有机物分子式的确定方法,难度不大,注意掌握燃烧热利用原子守恒确定有机物分子式.

练习册系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+2OH- |
12.能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)<c(H+)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
2.下列情况会破坏共价键的是( )
| A. | 氯化钠加热融化 | B. | 氢氧化钠溶于水 | ||
| C. | 氯化氢气体溶于水 | D. | 酒精溶于水 |
7.下列关于离子化合物的叙述正确的是( )
| A. | 离子化合物中的阳离子只能是金属离子 | |
| B. | 离子化合物中一定含有离子键 | |
| C. | 离子化合物都能溶于水,其水溶液可以导电 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
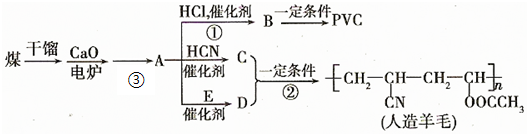
 ,CCH2═CHCN.
,CCH2═CHCN.