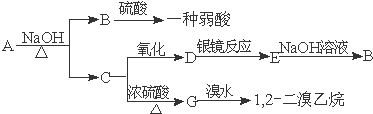
题目内容
2.用溶质的质量分数为10%的盐酸做导电性实验,然后均匀通入氨气,随着氨气的通入,电流计的读数①基本不变,其原因是②发生反应:NH3+H+═NH4+,单位体积的溶液中离子数目不变、离子电荷数也不变.分析 电解质溶液导电性能力离子浓度成正比,离子浓度越大物质的水溶液导电性越强,单位体积的溶液中离子数目不变,导电性基本不变,据此分析解答.
解答 解:用溶质的质量分数为10%的盐酸做导电性实验,然后均匀通入氨气,随着氨气的通入,发生反应:NH3+H+═NH4+,反应前后单位体积的溶液中离子数目不变、离子电荷数也不变,所以溶液 导电性基本不变,
故答案为:基本不变,发生反应:NH3+H+═NH4+,单位体积的溶液中离子数目不变、离子电荷数也不变.
点评 本题主要考查电解质的概念、导电能力与离子浓度的关系,溶液的导电能力与溶液中的离子浓度和离子带电荷数有关,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
12.NA为阿伏加德罗常数,下列叙述正确的是 ( )
| A. | 28gCO和N2混合气体中含有原子总数为2NA | |
| B. | 在1L1mol•L-1的氨水中含有NA个NH3分子 | |
| C. | 标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA | |
| D. | 1mol Fe分别与足量Cl2、S反应,Fe失去电子数都为2NA |
10.鲁米诺又名发光氨,广泛应用于刑事侦查、生物工程、化学示踪等领域.其制备方法之一如图: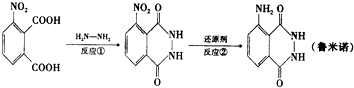
若反应②在催化剂作用下用H2还原,则制备1mol目标产物,理论上反应①与反应②生成水的质量比为( )

若反应②在催化剂作用下用H2还原,则制备1mol目标产物,理论上反应①与反应②生成水的质量比为( )
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
7.“84”消毒液有效成分为 NaClO,已知酸的电离平衡常数 H2CO3>HClO>HCO3- 下列说法正确的是( )
| A. | “84”消毒液可以与福尔马林溶液混合使用 | |
| B. | NaClO的稳定性和漂白性都比HClO强 | |
| C. | 工业上在特定条件下电解饱和食盐水制得NaClO,原理为:NaCl+H2O═NaClO+H2↑ | |
| D. | NaClO溶液在空气中发生离子反应为:2ClO-+CO2+H2O═2HClO+CO32- |
14.下列实验中,所选装置不合理的是( )


| A. | 分离Na2CO3溶液和苯,选④ | B. | 用CCl4提取碘水中的碘,选③ | ||
| C. | 用FeCl2溶液吸收Cl2,选⑤ | D. | 粗盐提纯,选①和② |
11.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 铝粉与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 利用腐蚀法制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 在氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |