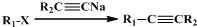题目内容
把50mL 2.0mol/L Fe2(SO4)3溶液和50mL 2.0mol/L H2SO4溶液混合(假设混合后溶液的体积等于混合前两溶液的体积之和).计算:
(1)混合液中Fe2(SO4)3和 H2SO4的物质的量;
(2)混合液中SO42-的物质的量浓度;
(3)向溶液中加入8.4g铁粉,经充分反应后,生成的气体在标准状况下的体积.
(1)混合液中Fe2(SO4)3和 H2SO4的物质的量;
(2)混合液中SO42-的物质的量浓度;
(3)向溶液中加入8.4g铁粉,经充分反应后,生成的气体在标准状况下的体积.
考点:有关混合物反应的计算
专题:
分析:(1)根据n=cV混合溶液中Fe2(SO4)3和H2SO4的物质的量;
(2)溶液中硫酸根来源于Fe2(SO4)3与硫酸电离,故 n(SO42-)=3n[Fe2(SO4)3]+n(H2SO4),再根据c=
计算;
(3)向溶液中加入铁粉,因为铁离子的氧化性大于氢离子的氧化性,所以铁先与铁离子反应,反应完了之后,若Fe有剩余,剩余的Fe再与氢离子反应生成氢气,结合方程式进行过量计算解答.
(2)溶液中硫酸根来源于Fe2(SO4)3与硫酸电离,故 n(SO42-)=3n[Fe2(SO4)3]+n(H2SO4),再根据c=
| n |
| V |
(3)向溶液中加入铁粉,因为铁离子的氧化性大于氢离子的氧化性,所以铁先与铁离子反应,反应完了之后,若Fe有剩余,剩余的Fe再与氢离子反应生成氢气,结合方程式进行过量计算解答.
解答:
解:(1)n[Fe2(SO4)3]=0.05L×2.0mol/L=0.1 mol,n(H2SO4)=0.05L×2mol/L=0.1mol,
答:混合溶液中Fe2(SO4)3的物质的量浓度0.1mol,H2SO4的物质的量为0.1mol;
(2)溶液中硫酸根来源于硫酸铜与硫酸电离,故 n(SO42-)=3n[Fe2(SO4)3]+n(H2SO4)=0.3mol+0.1mol=0.4mol,故c(SO42-)=
=4mol/L,
答:SO42-的物质的量浓度为4mol/L;
(3)溶液中n(Fe3+)=0.1mol×2=0.2mol,n(H+)=0.1mol×2=0.2mol,
8.4g Fe的物质的量为
=0.15mol,
Fe+2 Fe3+=3Fe2+
0.1mol 0.2mol
故剩余Fe为0.1mol,则:
Fe+2 H+=Fe2++H2↑
0.1mol 0.1mol 0.1mol
剩余的0.1molFe与硫酸恰好反应,生成0.1mol氢气,生成氢气的体积为0.1mol×22.4L/mol=2.24L,
答:标况下生成气体的体积为2.24L.
答:混合溶液中Fe2(SO4)3的物质的量浓度0.1mol,H2SO4的物质的量为0.1mol;
(2)溶液中硫酸根来源于硫酸铜与硫酸电离,故 n(SO42-)=3n[Fe2(SO4)3]+n(H2SO4)=0.3mol+0.1mol=0.4mol,故c(SO42-)=
| 0.4mol |
| 0.05L+0.05L |
答:SO42-的物质的量浓度为4mol/L;
(3)溶液中n(Fe3+)=0.1mol×2=0.2mol,n(H+)=0.1mol×2=0.2mol,
8.4g Fe的物质的量为
| 8.4g |
| 56g/mol |
Fe+2 Fe3+=3Fe2+
0.1mol 0.2mol
故剩余Fe为0.1mol,则:
Fe+2 H+=Fe2++H2↑
0.1mol 0.1mol 0.1mol
剩余的0.1molFe与硫酸恰好反应,生成0.1mol氢气,生成氢气的体积为0.1mol×22.4L/mol=2.24L,
答:标况下生成气体的体积为2.24L.
点评:本题考查物质的量浓度有关计算、混合物计算,难度不大,注意(3)中发生反应先后顺序,进行过量计算解答.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、在常温下,22.4L氧气所含的分子总数为NA |
| B、在标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1 |
| C、标准准况下,22.4L 乙醇中含有NA个乙醇分子 |
| D、在1L 0.1mol/L的碳酸钠溶液中,所含Na+的数目为0.2NA |
将质量为W1克的钠、铝共融物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体W2克.n(Na)、n(Al)分别代表钠、铝的物质的量,下列关系式中不正确的是( )
| A、35.5aV2=W2-W1 |
| B、n(Al)<W1/50 |
| C、n(Na)+3n(Al)=2V1/22.4 |
| D、aV2=n(Na)+3n(Al) |
下列装置或操作能达到实验目的是( )
A、 除去甲烷中乙烯 |
B、 从碘的CCl4溶液中分离出碘 |
C、 检查装置气密性 |
D、 分离甲苯与乙醇 |
下列反应的离子方程式正确的是( )
| A、溴水与碘化钾溶液:Br2+2I-=2Br-+I2 |
| B、钠与水:Na+H2O=Na++OH-+H2↑ |
| C、碳酸钙与稀盐酸:CO32-+2H+=CO2↑+H2O |
| D、硫酸铜溶液与氢氧化钡溶液:Cu2++2OH-=Cu(OH)2↓ |
 用下面三种方法均可制得Fe(OH)2白色沉淀.
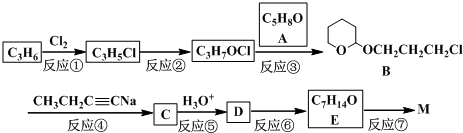
用下面三种方法均可制得Fe(OH)2白色沉淀.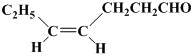 )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.