题目内容
5.已知在25℃,101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.4kJ热量.表示上述反应的热化学方程式正确的是( )| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.4 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.4 kJ•mol-1 |
分析 在25℃时,101kPa下,1g辛烷燃烧生成二氧化碳和液态水放出48.4KJ的热量,则1mol辛烷即114g辛烷燃烧生成二氧化碳和液态水放出48.4×114=5517.6KJ的热量,根据反应物和生成物的状态及反应热写出其热化学反应方程式.
解答 解:在25℃时,101kPa下,1g辛烷燃烧生成二氧化碳和液态水放出48.4KJ的热量,则1mol辛烷即114g辛烷燃烧生成二氧化碳和液态水放出48.4×114=5517.6KJ的热量,所以其热化学反应方程式为:C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6 kJ•mol-1,
故选B.
点评 本题考查了热化学反应方程式的书写,注意物质的聚集状态和对应化学方程式计量数的反应焓变计算,题目较简单.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
16.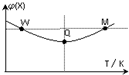 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数增大 | |
| B. | W点X的正反应速率小于M点X的正反应速率 | |
| C. | Q点时,Y的转化率最小 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
17.恒容容器中,2SO2(g)+O2(g)?2SO3 (g)△H=-296.6kJ/mol,下列判断不正确的是( )
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 平衡后再加入1molSO3,SO2的转化率增大 |
14.将下列各物质按酸、碱、盐的分类顺序排列,正确的是( )
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、硫酸钠 | D. | 磷酸、生石灰、苛性钠 |
15.在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
| A. | 乙烯 乙二醇: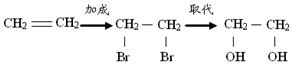 | |
| B. | 溴乙烷 乙醇:CH3CH2Br$\stackrel{水解}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷 1,3-丁二烯: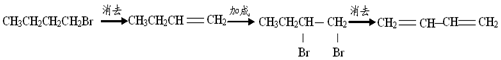 | |
| D. | 乙烯 乙炔: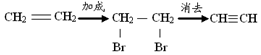 |