题目内容
(1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ,Al2(SO4)3溶液蒸干最后得到的固体产物是 ;
(2)明矾水溶液呈 性,原因是 ;(用离子方程式说明).碳酸钠水溶液呈 性,主要原因是 .(用离子方程式说明).把上述两溶液混合后呈现的现象有 ,反应现象的离子方程式是 .
(3)已知[Ksp(AgBr)]=5.4×10-13,[Ksp(AgCl)]=2.0×10-10.向浓度均为0.1mol?L-1的KBr、NaCl混合溶液中滴入0.1mol?L-1的AgNO3溶液,首先生成的沉淀是 .当容器中同时出现AgCl和AgBr沉淀,溶液中
= .
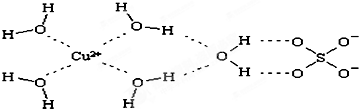
(4)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
①该温度下,中性溶液的pH= .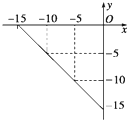
②该温度下0.01mol/L NaOH溶液的pH= .
(5)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、
⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH 由大到小的顺序为 (填序号)
(2)明矾水溶液呈
(3)已知[Ksp(AgBr)]=5.4×10-13,[Ksp(AgCl)]=2.0×10-10.向浓度均为0.1mol?L-1的KBr、NaCl混合溶液中滴入0.1mol?L-1的AgNO3溶液,首先生成的沉淀是
| c(Br-) |
| c(Cl-) |
(4)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
①该温度下,中性溶液的pH=

②该温度下0.01mol/L NaOH溶液的pH=
(5)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、
⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH 由大到小的顺序为
考点:盐类水解的应用,pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,氢氧化铝可分解,铝离子水解生成氢氧化铝和氢离子,溶液显示酸性,氢氧化铝受热分解生成氧化铝和水,硫酸铝水解生成氢氧化铝和硫酸,硫酸是难挥发的酸;
(2)明矾中铝离子水解生成氢离子和氢氧化铝,溶液显酸性;碳酸钠中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显碱性;两种溶液混合相互促进水解生成沉淀和气体,以此来解答;
(3)溶度积越小,越易生成沉淀,当容器中同时出现AgCl和AgBr沉淀,可根据溶度积计算;
(4)从图中数据计算离子积常数=c(H+).c(OH-),根据离子积常数计算氢离子浓度,进而求PH;
(5)先根据酸碱盐分类,再根据酸中酸的强弱分类,盐中盐的水解呈酸碱性分类比较.
(2)明矾中铝离子水解生成氢离子和氢氧化铝,溶液显酸性;碳酸钠中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显碱性;两种溶液混合相互促进水解生成沉淀和气体,以此来解答;
(3)溶度积越小,越易生成沉淀,当容器中同时出现AgCl和AgBr沉淀,可根据溶度积计算;
(4)从图中数据计算离子积常数=c(H+).c(OH-),根据离子积常数计算氢离子浓度,进而求PH;
(5)先根据酸碱盐分类,再根据酸中酸的强弱分类,盐中盐的水解呈酸碱性分类比较.
解答:
解:(1)氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,受热分解生成氧化铝和水;而硫酸难挥发,最终仍得到Al2(SO4)3;
故答案为:Al2O3;Al2(SO4)3;
(2)明矾溶液中发生Al3++3H2O?Al(OH)3+3H+,溶液显酸性;碳酸钠水溶液中发生CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液显碱性,将两种溶液混合后,发生3CO32-+2Al3++3H2O═2Al(OH)3↓+3CO2↑,可观察到有气体和白色沉淀生成,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;碱;CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,气体和白色沉淀生成;3CO32-+2Al3++3H2O═2Al(OH)3↓+3CO2↑;
(3)溶度积越小,越易生成沉淀,则首先生成AgBr,当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=
=
=2.7×10-3.
故答案为:AgBr;2.7×10-3;
(4)根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15,
中性溶液中,c(H+)=c(OH-)=
=10-7.5,pH=-lg10-7.5=7.5,
故答案为:7.5;
(2)该温度下,氢氧化钠溶液中氢离子浓度为10-13,pH=-1g10-13=13,
故答案为:13;
(5)酸:⑤CH3COOH 是弱电解质,所以只有部分电离,故C(H +)<0.1mol/L,所以pH>1;
碱:⑥NaOH是强电解质,完全电离,c(OH- )=0.1mol/L,所以pH=13;
⑦Ba(OH)2是强电解质,完全电离,c(OH- )=0.2mol/L,所以pH=13.7;
盐:④NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H +)=0.1mol/L,所以pH=1;
⑧NH4Cl是强酸弱碱盐,水解后溶液呈酸性,1<pH值<7;
①KNO3是强酸强碱盐,水溶液呈中性,pH=7;
②Na2CO3 是强碱弱酸盐,水溶液都呈碱性.
故答案为:⑦>⑥>②>①>⑧>⑤>④.
故答案为:Al2O3;Al2(SO4)3;
(2)明矾溶液中发生Al3++3H2O?Al(OH)3+3H+,溶液显酸性;碳酸钠水溶液中发生CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液显碱性,将两种溶液混合后,发生3CO32-+2Al3++3H2O═2Al(OH)3↓+3CO2↑,可观察到有气体和白色沉淀生成,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;碱;CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,气体和白色沉淀生成;3CO32-+2Al3++3H2O═2Al(OH)3↓+3CO2↑;
(3)溶度积越小,越易生成沉淀,则首先生成AgBr,当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=
| Ksp(AgBr) |
| Ksp(AgCl) |
| 5.4×10-13 |
| 2×10-10 |
故答案为:AgBr;2.7×10-3;
(4)根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15,
中性溶液中,c(H+)=c(OH-)=
| 10-15 |
故答案为:7.5;
| 10-15 |
| 0.01 |
(2)该温度下,氢氧化钠溶液中氢离子浓度为10-13,pH=-1g10-13=13,
故答案为:13;
(5)酸:⑤CH3COOH 是弱电解质,所以只有部分电离,故C(H +)<0.1mol/L,所以pH>1;
碱:⑥NaOH是强电解质,完全电离,c(OH- )=0.1mol/L,所以pH=13;
⑦Ba(OH)2是强电解质,完全电离,c(OH- )=0.2mol/L,所以pH=13.7;
盐:④NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H +)=0.1mol/L,所以pH=1;
⑧NH4Cl是强酸弱碱盐,水解后溶液呈酸性,1<pH值<7;
①KNO3是强酸强碱盐,水溶液呈中性,pH=7;
②Na2CO3 是强碱弱酸盐,水溶液都呈碱性.
故答案为:⑦>⑥>②>①>⑧>⑤>④.
点评:本题考查了电解质溶液中离子浓度比较,盐类水解分析应用,该题是基础性试题的考查,试题难易适中,基础性强.该题的关键是明确盐类水解的原理,离子积常数的有关计算,注意纯水中氢离子浓度等于氢氧根离子浓度,然后结合提高信息灵活运用即可,有利于培养学生的灵活应变能力,答题时注意理解难溶电解质的溶解平衡问题以及利用溶度积的计算方法.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列氧化还原反应中,实际参加反应的氧化剂与还原剂物质的量之比正确的是( )
①2H2S+SO2=3S+2H2O; 1:2
②6HNO3(浓)+S=H2SO4+6NO2+2H2O; 6:1
③Fe+4HNO3=Fe(NO3)3+NO+2H2O; 1:1
④2Na2O2+2H2O=4NaOH+O2; 1:1.
①2H2S+SO2=3S+2H2O; 1:2
②6HNO3(浓)+S=H2SO4+6NO2+2H2O; 6:1
③Fe+4HNO3=Fe(NO3)3+NO+2H2O; 1:1
④2Na2O2+2H2O=4NaOH+O2; 1:1.
| A、只有①正确 |
| B、只有③ |
| C、只有①和④ |
| D、①②③④都正确 |
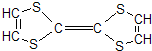 用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图所示.关于其性质的描述不正确的是( )
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图所示.关于其性质的描述不正确的是( )| A、能使溴水和酸性KMnO4溶液褪色 |
| B、1mol该物质可与3molH2完全加成 |
| C、该物质在空气燃烧产生刺激性气体 |
| D、该物质属于烯烃 |
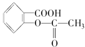 ,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成(用结构简式表示)
,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成(用结构简式表示)
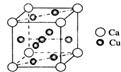 是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为
是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为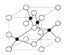 是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为
是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为