题目内容
7.下列有关说法正确的是( )| A. | 反应2CO(g)=2C(s)+O2(g)△H>0可以自发进行 | |
| B. | 放热反应在常温条件下一定很容易进行 | |
| C. | 平衡常数发生变化,化学平衡一定发生移动 | |
| D. | 化学平衡发生移动,平衡常数一定发生改变 |
分析 A.△G=△H-T△S<0时,该反应能自发进行,据此进行判断;
B.反应条件与放热反应、吸热反应没有必然关系;
C.平衡常数只受温度影响,若平衡常数改变,说明温度发生变化,则化学平衡一定破坏;
D.化学平衡发生移动时,若温度不变,则平衡常数不变.
解答 解:A.反应2CO(g)=2C(s)+O2(g)△H>0,该反应为气体体积缩小的反应,则熵变△S<0,则△G=△H-T△S>0,该反应不能自发进行,故A错误;
B.放热反应在常温下不一定能够自发进行,如氢气燃烧、铝热反应等,故B错误;
C.平衡常数为温度的函数,若平衡常数发生变化,说明温度发生改变,则化学平衡一定发生移动,故C正确;
D.改变压强或浓度,化学平衡可能发生移动,由于温度不变,则化学平衡常数不变,故D错误;
故选C.
点评 本题考查了反应热与焓变的综合应用,题目难度中等,明确化学平衡常数的影响因素为解答关键,注意掌握判断反应自发进行的依据,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.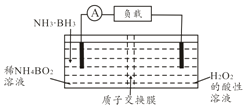 直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
 直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )| A. | 左侧电极发生还原反应 | |
| B. | 电池工作时,H+通过质子交换膜向负极移动 | |
| C. | 正极的电极反应式为2H++2e-=H2↑ | |
| D. | 消耗3.1g氨硼烷,理论上转移0.6mol电子 |
18.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. |  实验室制取Cl2 | D. |  中和热的测定 |
15.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到NaOH浓溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干,趁热过滤 |
| C | 除去HBr中混有的Br2 | 将混合气通入盛有CCl4的洗气瓶 |
| D | 证明Cu(OH)2的溶度积比Mg(OH)2的小 | 将1mL0.1mol•L-1MgSO4溶液逐滴滴入4mL0.1mol•L-1NaOH溶液,再滴加1mL0.1mol•LCuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.X(s)+3Y(g)?Z(g)△H=-a kJ•mol-1,一定条件下,将2mol X和2mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ.下列说法正确的是( )
| A. | 10s内,X的平均反应速率为0.025 mol•L-1•s-1 | |
| B. | 第10s时,Y的反应速率为0.075 mol•L-1•s-1 | |
| C. | 第10s时,X为 1.5 mol,Y的浓度为0.25 mol•L-1 | |
| D. | 10s内,X和Y反应放出的热量为a kJ |
17.已知有如下反应:
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>BrO3->ClO3->HIO3 | B. | ClO3->BrO3->HIO3>Cl2 | ||
| C. | BrO3->Cl2>ClO3->HIO3 | D. | BrO3->ClO3->Cl2>HIO3 |
 .
. .
. .
.