题目内容
3.在某稀溶液中含有0.2molHNO3和xmolH2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标准状况下的体积为4.48L,则x值至少为( )| A. | 0.6 | B. | 0.4 | C. | 0.3 | D. | 0.2 |
分析 发生3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,根据原子守恒知,硝酸根离子完全被还原生成NO,n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,可知Cu、NO3-均恰好完全反应,结合反应计算.
解答 解:n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
由3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,
需要氢离子为0.8mol,
则0.8mol=0.2mol+2x,
解得x=0.3mol,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.

练习册系列答案
相关题目
13.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是( )
| A. | NaHCO3溶液和NaOH溶液 | B. | NaOH溶液和CO2 | ||
| C. | Na和O2 | D. | Na2CO3溶液和盐酸 |
14.某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色.则原溶液中可能含有( )
| A. | Na+ NH4+ Cl- | B. | Fe3+Fe2+SO42- | ||
| C. | K+Fe3+NO3- | D. | Na+Fe2+ Cl- |
11.下列关于Na2CO3和NaHCO3的说法不正确的是( )
| A. | 受热时的稳定性:Na2CO3>NaHCO3 | |
| B. | 使酚酞试液变红的程度:Na2CO3>NaHCO3 | |
| C. | 与同浓度同体积HCl反应产生气泡的速率:Na2CO3<NaHCO3 | |
| D. | 同物质的量与足量HCl反应生成CO2的量:Na2CO3<NaHCO3 |
18.饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉NO3-还原为N2,反应的转化为:Al+NaNO3+NaOH→NaAlO2+N2+H2O(未配平)下列有关该反应说法不正确的是( )
| A. | NaOH表现碱性 | |
| B. | NaNO3是氧化产物,N2是还原产物 | |
| C. | 每生成1molN2转移10mole- | |
| D. | 氧化剂与还原剂物质的量之比为5:3 |
1.向100mL0.04mol/L的Ca(OH)2溶液中通入CO2气体,当得到0.1g沉淀时,通入CO2的物质的量是( )
| A. | 0.014 mol | B. | 0.01 mol | C. | 0.007 mol | D. | 0.005 mol |
8.为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池 Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l) 电解池 2Al+3H2O=Al2O3+3H2,对该电解过程,以下判断正确的是( )
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗6molPb] | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | Pb电极反应质量不变 | Pb电极反应质量不变 |
| A. | A | B. | B | C. | C | D. | D |
5.下列实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系不正确的是( )
| A. | 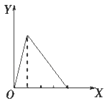 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| B. | 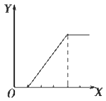 向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡W | |
| C. |  向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量8 | |
| D. | 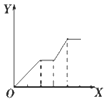 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
6.甲~辛等元素在周期表中的位置如下表所示.下列说法正确的是( )


| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |