题目内容
10.下列说法正确的是( )| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
分析 A.醋酸为弱酸,不能完全电离;
B.加入少量硫酸铜固体,锌置换出铜,可形成原电池反应;
C.镁和氢氧化钠溶液不反应;
D.固体表面积大的反应速率较大.
解答 解:A.醋酸为弱酸,不能完全电离,溶液中氢离子浓度较小,则反应速率减小,故A错误;
B.加入少量硫酸铜固体,锌置换出铜,可形成原电池反应,可加快反应速率,故B正确;
C.镁和氢氧化钠溶液不反应,故C错误;
D.固体表面积大的反应速率较大,块状的表面积较小,反应速率减小,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、压强、催化剂对反应速率影响的实质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
7.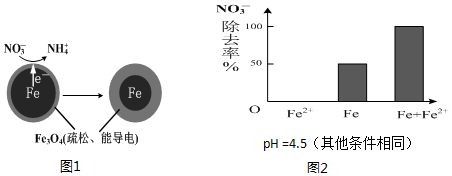 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图1所示.正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
pH=4.5时,NO3-的去除率低.其原因是FeO(OH)不导电,阻碍电子转移.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:pH=4.5(其他条件相同)
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层.
①对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.(1)Fe还原水体中NO3-的反应原理如图1所示.正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 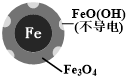 | 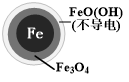 |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:pH=4.5(其他条件相同)
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层.
①对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
1.向100mL0.04mol/L的Ca(OH)2溶液中通入CO2气体,当得到0.1g沉淀时,通入CO2的物质的量是( )
| A. | 0.014 mol | B. | 0.01 mol | C. | 0.007 mol | D. | 0.005 mol |
18.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 任何条件下,16gCH4与18 g H2O所含有电子数均为10NA | |
| B. | 19g的H3O+离子中含有的电子数为11NA | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
5.下列实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系不正确的是( )
| A. | 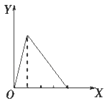 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| B. | 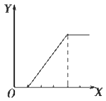 向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡W | |
| C. |  向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量8 | |
| D. | 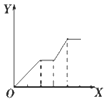 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
2.下列药品的保存错误的是( )
| A. | 白磷放在水中 | |
| B. | 酒精等易燃物应敞口放置且远离火源 | |
| C. | 氯酸钾、硝酸铵不要同可燃物混放,防爆炸 | |
| D. | 浓硫酸与固体氢氧化钠都需要密封保存 |
19.下列有关物质分类或归类正确的一组是( )
①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物.
①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物.
| A. | ①和③ | B. | ③和④ | C. | ②和③ | D. | ②和⑤ |
20.下列事实中,与电化学腐蚀无关的是( )
| A. | 镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| B. | 在空气中,光亮的银器表面逐渐变暗 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |