题目内容
9.对于反应3H2(g)+N2(g)?2NH3(g)△H<0.,达到平衡后,以下分析正确的是( )| A. | 升高温度,正反应的反应速率变快,逆反应速率变慢,平衡向正反应方向移动 | |
| B. | 减小反应物浓度,逆反应的速率变慢,正反应速率变快,平衡向正反应方向移动 | |
| C. | 增大压强,正反应的反应速率加快,逆反应速率也加快,平衡向正反应方向移动 | |
| D. | 加入正催化剂,对正反应的反应速率影响更大 |
分析 对于反应3H2(g)+N2(g)?2NH3(g)△H<0,反应物气体的计量数之和大于生成物,增大压强,正逆反应速率都增大,平衡正向移动,该反应的正反应为放热反应,升高温度,平衡逆向移动,加入催化剂,平衡不移动,以此解答该题.
解答 解:A.升高温度,正逆反应速率都增大,故A错误;
B.减小浓度,正逆反应速率都减小,故B错误;
C.反应物气体的计量数之和大于生成物,增大压强,正逆反应速率都增大,平衡正向移动,故C正确;
D.加入催化剂,同等程度改变反应速率,故D错误.
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确外界条件对化学平衡影响原理是解本题关键,注意结合反应特点分析,注意:催化剂影响反应速率但不影响平衡移动.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
20.“化学--我们的生活,我们的未来”.下列有关叙述错误的是( )
| A. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 大量排放SO2或CO2都会导致酸雨的形成 | |
| C. | 采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 利用清洁能源如太阳能、潮汐能、风能来发电 |
17.关于粗盐提纯的下列说法中正确的是( )
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |
14.能大量共存且溶液为无色透明的离子组是( )
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
18.在容积一定的密闭容器中,反应2A?B (g)+C (g)达到平衡后,升高温度容器内气体密度增大,则下列叙述正确的是( )
| A. | 改变压强对该平衡的移动无影响 | |
| B. | 正反应是放热反应且A不是气态 | |
| C. | 其它条件不变,加入少量A,该平衡向正反应方向移动 | |
| D. | 正反应是吸热反应且A不是气态 |
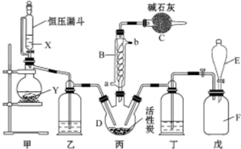 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.