题目内容
下表列出了A~R8种元素在周期表中的位置:
(1)E、F、G、H四种元素的元素名称分别是E ,F ,G ,H .
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是 .
(3)A、B、C三种元素按原子半径由大到小的顺序排列为 (用元素符号表示)
(4)写出E的氢化物的结构式 ,电子式 .
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | ||||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
(3)A、B、C三种元素按原子半径由大到小的顺序排列为
(4)写出E的氢化物的结构式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素在周期表中的位置可知,E为C、F为O、G为Cl、H为Br;
(2)D为Al,其最高价氧化物对应的水化物为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水;
(3)A为Na、B为K、C为Mg,同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)E为C元素,氢化物为CH4,分子中C原子与H原子之间形成1对共用电子对.
(2)D为Al,其最高价氧化物对应的水化物为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水;
(3)A为Na、B为K、C为Mg,同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)E为C元素,氢化物为CH4,分子中C原子与H原子之间形成1对共用电子对.
解答:
解:(1)由元素在周期表中的位置可知,E为C、F为O、G为Cl、H为Br,故答案为:碳;氧;氯;溴;
(2)D为Al,其最高价氧化物对应的水化物为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)A为Na、B为K、C为Mg,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)E为C元素,氢化物为CH4,分子中C原子与H原子之间形成1对共用电子对,其结构式为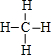 ,电子书为:
,电子书为: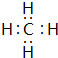 ,
,
故答案为: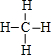 ;
;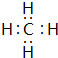 .
.
(2)D为Al,其最高价氧化物对应的水化物为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)A为Na、B为K、C为Mg,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)E为C元素,氢化物为CH4,分子中C原子与H原子之间形成1对共用电子对,其结构式为
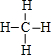 ,电子书为:
,电子书为: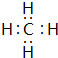 ,
,故答案为:
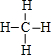 ;
;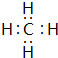 .
.
点评:本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期律的结构,侧重对基础知识的巩固.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
设NA表示阿伏加德罗常数的数值,下列判断正确的是( )
| A、常温常压下,22.4L CH4中含有的C-H键数为4NA |
| B、4.6g由NO2和N2O4组成的混合气体中含有的氧原子数为0.3NA |
| C、含0.2mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D、1mol Na在足量O2中燃烧生成Na2O2,钠失去的电子数为NA |
 是由一种单体缩聚而成的,该单体的键线式为
是由一种单体缩聚而成的,该单体的键线式为 )滴入Na2CO3溶液中发生的化学方程式:
)滴入Na2CO3溶液中发生的化学方程式: