题目内容
14.下列实验设计正确的是( )| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水滴入某溶液证明其中存在CO32- | |
| D. | 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性 |
分析 A、SO2通入溴水褪色是发生氧化还原反应而褪色,体现二氧化硫的还原性;
B、将铁屑放入稀HNO3中是硝酸的强氧化性;
C、将澄清石灰水滴入某溶液有沉淀产生,不能证明其中存在CO32-,还可能存在碳酸氢根离子和亚硫酸根、亚硫酸氢根离子;
D、乙烯有还原性,能被高锰酸钾氧化.
解答 解:A、SO2通入溴水褪色是发生氧化还原反应而褪色,体现二氧化硫的还原性,而不是漂白性,故A错误;
B、将铁屑放入稀HNO3中是硝酸的强氧化性,生成氮的氧化物,而不产生氢气,所以不能证明Fe比H2活泼,故B错误;
C、将澄清石灰水滴入某溶液有沉淀产生,不能证明其中存在CO32-,还可能存在碳酸氢根离子和亚硫酸根、亚硫酸氢根离子,故C错误;
D、乙烯有还原性,能被高锰酸钾氧化,使其褪色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及氧化还原反应、乙烯有还原性等,注重物质性质及物质分类的考查,综合性较强,但题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列有关实验原理、现象、结论均正确的是( )
| A. |  图中滴加乙醇,试管中橙色溶液变为绿色,说明K2Cr2O4被还原成K2CrO4 | |
| B. |  图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. |  图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO | |
| D. |  图中,试管中先出现白色沉淀、加Na2S后产生黑色沉淀,但不能验证AgCl的溶解度大于Ag2S |
2.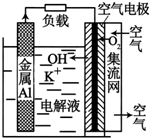 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )| A. | 铝-空气电池要及时回收处理,以免造成重金属污染 | |
| B. | 每消耗1molAl,电解质溶液中会有3 mol电子通过 | |
| C. | 负极上的电极反应式为:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 电池总反应式为:Al+KOH+O2═KAlO2+H2O |
9.下列物质不可用作食品添加剂的是( )
| A. | 谷氨酸单钠 | B. | 柠檬酸 | C. | 山梨酸钾 | D. | 三聚氰胺 |
19.工业上可由乙苯生产苯乙烯: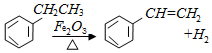 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用Br2、CCl4鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
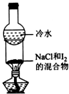
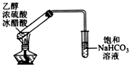
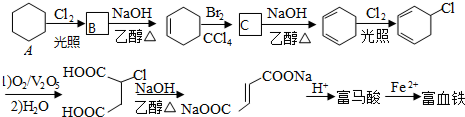
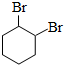 .
. .
.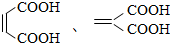 (写出结构简式).
(写出结构简式).
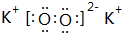 .
.