题目内容
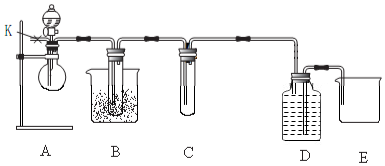
2.某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)仪器A的名称是圆底烧瓶,B中反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
(2)D的作用是干燥氢氢(或除掉氢气中的水蒸气),
(3)E中的现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,
(4)写出E中发生反应的方程式并标出电子转移的数目和方向
 .
.
分析 (1)仪器A的名称是圆底烧瓶,B中是铁与水蒸气反应生成氢气和四氧化三铁;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂;
(3)根据氢气还原氧化铜得到铜和水进行分析;
(4)该反应中Cu元素化合价由+2价变为0价、H元素化合价由0价变为+1价,转移电子数目为2,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂.
解答 解:(1)仪器A的名称是圆底烧瓶,B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:圆底烧瓶; 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,
故答案为:干燥氢氢(或除掉氢气中的水蒸气);
(3)氢气还原氧化铜得到铜和水即H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,
故答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;
(4)H2还原CuO的方程式和电子转移的数目和方向, ,
,
故答案为: .
.
点评 本题考查了铁与水蒸气反应方程式的书写,利用氢气还原氧化铜这个实验对产物氢气进行检验,考查了实验操作中的注意事项,题目较简单.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
15.下列相关实验能达到预期目的是( )
| 选项 | 实验操作 | 实验目的 |
| A. | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化. | 验证浓度对化学平衡的影响 |
| B. | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和硫酸中,观察气泡产生的快慢. | 验证固体接触面积对化学反应速率的影响 |
| C. | 相同温度下,两只试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量MnO2固体. | 验证不同催化剂对H2O2分解速率的影响 |
| D. | 将SO2气体通入溴水中,观察溶液颜色的变化 | 证明SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
14.李强在学习了高中化学《铁及其化合物》一节的知识后,对初中“铁丝在氧气中燃烧”实验中的产物产生了疑惑,他认为燃烧时溅落下来的黑色物质中除了Fe3O4外可能还含有其他物质,为了验证自己的猜想,他在实验室中重做该实验,并进行了如下探究活动:查阅资料:①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种,FeO高温时极易被氧化为Fe2O3,而Fe2O3在高温时又容易分解成Fe3O4和一种气体;②铁的氧化物的分解温度及铁的熔点:
(1)根据以上资料,李强提出猜想:黑色物质的成分可能为Fe和Fe3O4.为了确定黑色物质的成分,李强设计了如下几个实验方案:
方案1:取该黑色物质溶于足量的稀硫酸中,观察是否有大量气体生成.
方案2:称取碾碎成粉末状的黑色物质a g,在空气中充分灼烧,待反应完全后,在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b的关系.
方案3:取少量碾碎成粉末状的黑色物质,用磁铁吸引,看是否被吸起.
你认为能够证明李强猜想的合理实验方案是方案2,其他方案不合理的原因是黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象(只说其中的一个理由).
(2)针对李强的质疑,研究性学习小组又设计了新的探究方案,装置如下图所示.
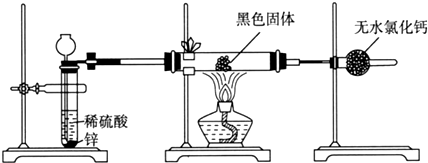
a.若反应都进行完全,要想确定黑色固体成分必须测定下列物理量中的②③⑤(只填序号).
①通入氢气体积V ②反应前,黑色固体+硬质玻璃管的总质量m1 ③完全反应后黑色固体+硬质玻璃管的总质量m2 ④实验前,干燥管质量m3 ⑤硬质玻璃管质量m4 ⑥锌粒质量m5 ⑦稀硫酸中含溶质的量n ⑧实验后,干燥管质量m6.
b.根据测定的实验数据,计算出黑色固体中Fe3O4的质量分数为$\frac{29(m1-m2)}{8(m2-m3)}$.
(3)向一定量FeO、Fe和Fe3O4的混合物中加入100 mL l.5 mol•L-1的盐酸,使混合物完全溶解,放出224mL(标准状况)气体,再向反应后的溶液中加入1 mol•L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少为C
A.90 mL B.100 mL C.150 mL D.200 mL.
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
方案1:取该黑色物质溶于足量的稀硫酸中,观察是否有大量气体生成.
方案2:称取碾碎成粉末状的黑色物质a g,在空气中充分灼烧,待反应完全后,在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b的关系.
方案3:取少量碾碎成粉末状的黑色物质,用磁铁吸引,看是否被吸起.
你认为能够证明李强猜想的合理实验方案是方案2,其他方案不合理的原因是黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象(只说其中的一个理由).
(2)针对李强的质疑,研究性学习小组又设计了新的探究方案,装置如下图所示.

a.若反应都进行完全,要想确定黑色固体成分必须测定下列物理量中的②③⑤(只填序号).
①通入氢气体积V ②反应前,黑色固体+硬质玻璃管的总质量m1 ③完全反应后黑色固体+硬质玻璃管的总质量m2 ④实验前,干燥管质量m3 ⑤硬质玻璃管质量m4 ⑥锌粒质量m5 ⑦稀硫酸中含溶质的量n ⑧实验后,干燥管质量m6.
b.根据测定的实验数据,计算出黑色固体中Fe3O4的质量分数为$\frac{29(m1-m2)}{8(m2-m3)}$.
(3)向一定量FeO、Fe和Fe3O4的混合物中加入100 mL l.5 mol•L-1的盐酸,使混合物完全溶解,放出224mL(标准状况)气体,再向反应后的溶液中加入1 mol•L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少为C
A.90 mL B.100 mL C.150 mL D.200 mL.
 回答下列问题:
回答下列问题:
 FeCl3•6H2O晶体
FeCl3•6H2O晶体 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题: