题目内容
16.CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是( )| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、可逆反应不可能完全转化,故A错误;
B、断4NA个H-H键的同时,生成46g乙醇,都体现正反应方向,故B错误;
C、如果体积不变,密度始终不变,所以密度不变,不一定达到最大限度,故C错误;
D、若反应在绝热密闭容器中进行,容器中温度不再改变,说明正逆反应速率相等,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列因果关系叙述正确的是( )
| A. | 浓硝酸中的HNO3见光会分解,因此有时在实验室看到的浓硝酸呈黄色 | |
| B. | SO2具有漂白性,因此可使溴水褪色 | |
| C. | Na的金属性比Cu强,因此可用Na与CuSO4溶液反应制取Cu | |
| D. | Fe在Cl2中燃烧生成FeCl3,因此在与其他非金属反应的产物中Fe也显+3价 |
7.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与 Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W 与 X、Y 既不同族也不同周期且 W 不为稀有气体元素; X、Y、Z 三种元素的族序数之和为16.下列说法正确的是( )
| A. | Q 与 W不能形成 10电子、14电子、18 电子分子 | |
| B. | Y 的最高价氧化物对应水化物的化学式只能表示为 H4YO4 | |
| C. | Y、Z、Q 分别与 X 化合,只能形成 AB2型化合物 | |
| D. | X、Z、W 中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
4.密闭容器中,投入NO2和SO2,起始浓度如表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2min的平均速率v(SO2)=0.05mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2,达到平衡时c(NO)与原平衡不相同 |
11.下列说法正确的是( )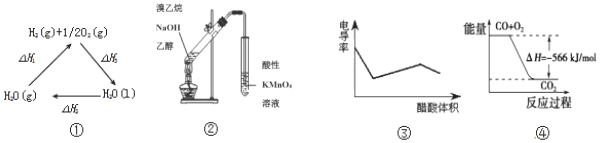

| A. | 图①中△H1=△H2+△H3 | |
| B. | 图②可用于证明实验中生成了乙烯 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
1.下列各组物质不属于同系物的是( )
| A. |  和 和 | B. | HOCH2-CH2OH和 | C. | CH3CH2OH和  | D. | HOCH2CH2OH和  |
8.下列叙述正确的是( )
| A. | 第一电离能:F>O>N | |
| B. | 离子晶体中一定存在离子键 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 白磷为分子晶体,分子结构为正四面体,其键角为109.5° |
5.将钠、镁、铝各0.3mol分别放入100mL 2mol•L-1的盐酸中,同温同压下产生气体的体积比是( )
| A. | 1:1:1 | B. | 3:2:2 | C. | 1:2:3 | D. | 6:3:2 |
6.下列说法正确的是( )
| A. | 二氧化硫可用于杀菌、消毒 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁能源 | |
| C. | 氯气和明矾均可做自来水的消毒剂 | |
| D. | 食品保鲜剂中所含铁粉和生石灰均作还原剂 |