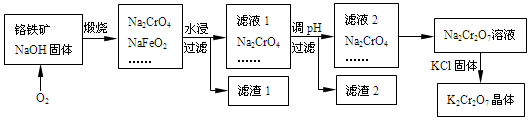
题目内容
5.将钠、镁、铝各0.3mol分别放入100mL 2mol•L-1的盐酸中,同温同压下产生气体的体积比是( )| A. | 1:1:1 | B. | 3:2:2 | C. | 1:2:3 | D. | 6:3:2 |
分析 钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=2mol/L×0.1L=0.2mol,所以镁和铝都剩余,计算生成氢气物质的量,相同条件下气体体积之比等于物质的量之比,以此解答该题.
解答 解:钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=2mol/L×0.1L=0.2mol,所以镁和铝都剩余,
根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×$\frac{1}{2}$=0.15mol,
镁和铝都剩余,所以二者与酸反应生成氢气的量相等,根据氢原子守恒,可知生成氢气的量=$\frac{0.2mol}{2}$=0.1mol,
所以同温同压下产生的气体的物质的量之比=0.15mol:0.1mol:0.1mol=3:2:2,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒为解答的关键,注意Na过量可与水反应生成氢气,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
15.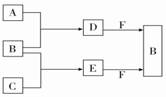 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )| A. | F中阴阳离子个数比为1:1 | |
| B. | 化合物F中既有离子键又有共价键 | |
| C. | 合成过程中的反应均是氧化还原反应 | |
| D. | 1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值) |
16.CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是( )
| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
13.下列说法中正确的是( )
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
20.W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
14.下列对有机物的认识正确的是( )
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | 分子式为C5H12O的醇类有5种结构 | |
| C. | 乙醇发生氧化反应生成乙酸,乙酸和乙醇发生取代反应生成乙酸乙酯 | |
| D. | 有机物甲的分子式为C3H6,则甲与乙烯(C2H4)互为同系物 |
1.下列叙述错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 气体摩尔体积在非标准状况下也有可能是22.4L/mol | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | 物质的量是国际单位制中七个基本物理量之一 |