题目内容
能正确表示下列反应的离子反应方程式为( )
| A、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| C、大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.漏掉氨根离子与氢氧根离子的反应;
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子;
C.醋酸为弱电解质应保留化学式;
D.向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,反应生成硫酸钡、偏铝酸钾.
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子;
C.醋酸为弱电解质应保留化学式;
D.向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,反应生成硫酸钡、偏铝酸钾.
解答:
解:A.NH4HCO3溶于过量的NaOH溶液中,离子方程式为:NH4++HCO3-+2OH-═CO32-+H2O+NH3.H2O,故A错误;
B.向FeBr2溶液中通入足量氯气,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B正确;
C.大理石溶于醋酸溶液,离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O=2CH3COO-,故C错误;
D.向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选:B.
B.向FeBr2溶液中通入足量氯气,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B正确;
C.大理石溶于醋酸溶液,离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O=2CH3COO-,故C错误;
D.向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,题目难度不大,明确反应的实质是解题关键,注意化学式的拆分和反应物用量对反应的影响,B为易错选项.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列元素电负性最大的是( )
| A、C | B、N | C、O | D、F |
下列4支试管中,等质量的铁与足量等体积的盐酸反应生成H2的反应速率最大的是( )
| 试管 | 盐酸浓度(mol?L-1) | 温度(℃) | 铁的状态 |
| A | 1.0 | 20 | 块状 |
| B | 1.0 | 20 | 粉末状 |
| C | 3.0 | 30 | 块状 |
| D | 3.0 | 30 | 粉末状 |
| A、A | B、B | C、C | D、D |
在含有
、Cl-的溶液中,为了检验其中是否还含有
,除BaCl2溶液外,还需要的溶液是( )
| CO | 2- 3 |
| SO | 2- 4 |
| A、少量H2SO4溶液 |
| B、少量HNO3溶液 |
| C、足量NaOH溶液 |
| D、足量盐酸 |
下列事实能用同一原理解释的是:( )
| A、Na2O2和活性炭均能使品红溶液褪色 |
| B、对碘晶体和碳酸氢铵晶体加热,晶体均会逐渐消失 |
| C、实验室配制FeCl3和SnCl2溶液时,先将固体FeCl3和SnCl2分别溶解在浓盐酸中,再加蒸馏水稀释 |
| D、SO2能使滴加酚酞的NaOH溶液和酸性KMnO4溶液的红色都褪去 |
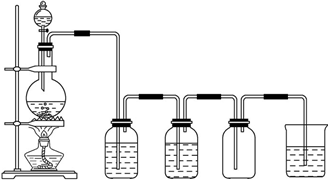
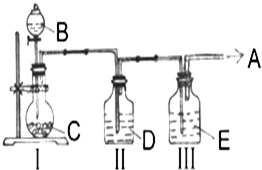 实验室中制取少量干燥纯净的气体A,可用如图装置
实验室中制取少量干燥纯净的气体A,可用如图装置