题目内容
下列叙述中,正确的是( )
| A、如果加四氯化碳呈现紫色,证明原溶液中存在I- |
| B、加入盐酸产生白色沉淀的溶液一定是硝酸银溶液 |
| C、二氧化硅是酸性氧化物,能够与水反应生成酸 |
| D、氢氟酸是弱酸,但会腐蚀玻璃 |
考点:常见阴离子的检验,氯、溴、碘及其化合物的综合应用,硅和二氧化硅,物质的检验和鉴别的基本方法选择及应用
专题:元素及其化合物
分析:A、碘单质易溶于有机溶剂;
B、银离子和氯离子反应产生氯化银白色沉淀;
C、二氧化硅是酸性氧化物,不能够与水直接反应;
D、氢氟酸属于弱电解质,氢氟酸与玻璃的主要成分二氧化硅反应,能够腐蚀玻璃.
B、银离子和氯离子反应产生氯化银白色沉淀;
C、二氧化硅是酸性氧化物,不能够与水直接反应;
D、氢氟酸属于弱电解质,氢氟酸与玻璃的主要成分二氧化硅反应,能够腐蚀玻璃.
解答:
解:A、因碘单质易溶于有机溶剂,则如果加四氯化碳呈现紫色,证明原溶液中存在I2,故A错误;
B、银离子和氯离子反应产生氯化银白色沉淀,证明溶液中含有银离子,不一定是硝酸银,故B错误;
C、二氧化硅是酸性氧化物,不能够与水直接反应生成硅酸,故C错误;
D、氢氟酸为弱电解质,在溶液中部分电离,属于弱酸,氢氟酸能够与二氧化硅反应,所以能够腐蚀玻璃,故D正确;
故选:D.
B、银离子和氯离子反应产生氯化银白色沉淀,证明溶液中含有银离子,不一定是硝酸银,故B错误;
C、二氧化硅是酸性氧化物,不能够与水直接反应生成硅酸,故C错误;
D、氢氟酸为弱电解质,在溶液中部分电离,属于弱酸,氢氟酸能够与二氧化硅反应,所以能够腐蚀玻璃,故D正确;
故选:D.
点评:本题考查硫酸根离子的检验,要掌握常见离子的检验方法,注意排除其它离子的干扰,注意氢氟酸的性质.

练习册系列答案
相关题目
已知:Cu2O+2H+=Cu2++Cu+H2O为检验某金属铜粉末样品中是否含有Cu2O,某同学设计了如下方案,其中不合理的是( )
| A、将足量CO通过灼热样品,冷却后称量,若固体质量减小,则含有Cu2O |
| B、将干燥的氢气通过灼热的样品,再通过无水硫酸铜,若无水硫酸铜变蓝,则含有Cu2O |
| C、取少量样品,加入稀硝酸,充分震荡后若观察到溶液呈蓝色,则含有Cu2O |
| D、取少量样品,加入稀硫酸,充分震荡后若观察到溶液呈蓝色,则含有Cu2O |
常温时,将a1 mL、b1 mol?L-1的CH3COOH溶液加入到a2 mL、b2 mol?L-1的NaOH溶液中,下列结论中正确的是( )
| A、如果a1b1=a2b2,则混合溶液的pH=7 |
| B、如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| C、如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) |
| D、如果a1=a2,且混合溶液的pH>7,则b1<b2 |
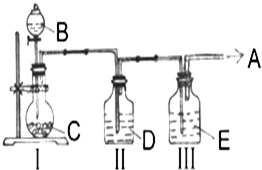 实验室中制取少量干燥纯净的气体A,可用如图装置
实验室中制取少量干燥纯净的气体A,可用如图装置