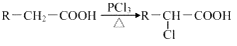
题目内容
13.下列可逆反应达到平衡后,加压或升高温度可使平衡向逆反应方向移动的是( )| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
分析 加压或升高温度可使平衡向逆反应方向移动,可知反应为气体体积增大、且放热的反应,以此来解答.
解答 解:A.该反应为气体体积不变的反应,增大压强,平衡不移动,故A不选;
B.反应为气体体积增大、且放热的反应,加压或升高温度可使平衡向逆反应方向移动,故B选;
C.该反应为气体体积不变的反应,增大压强,平衡不移动,故C不选;
D.该反应为吸热反应,升高温度,平衡正向移动,故D不选;
故选B.
点评 本题考查化学平衡移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意分析反应的特点,题目难度不大.

练习册系列答案
相关题目
18.下列关于钠的叙述中,不正确的是( )
| A. | 钠燃烧时生成氧化钠 | B. | 钠有很强的还原性 | ||
| C. | 钠原子的最外层只有一个电子 | D. | 钠燃烧时发出黄色火焰 |
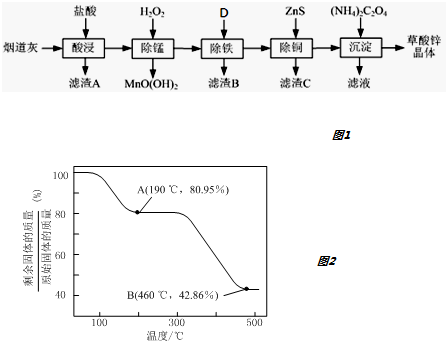
1.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O).如图1
有关氢氧化物开始沉淀和沉淀完全的pH如表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.



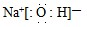 ;
;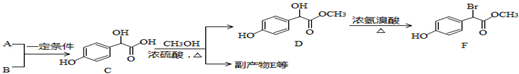
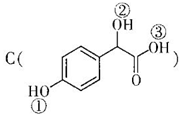 中①、②、③3个-OH的酸性有强到弱的顺
中①、②、③3个-OH的酸性有强到弱的顺