题目内容
8.扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F路线如图: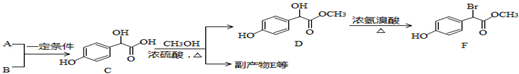
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:
醛基和羧基.
(2)
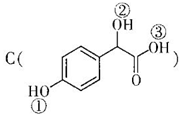 中①、②、③3个-OH的酸性有强到弱的顺
中①、②、③3个-OH的酸性有强到弱的顺 序是:③>①>②.
(3)E是由2分子C生成的含有3个六元环的化合物,写出E的结构简式:

(4)D→F的反应类型是取代反应,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:3mol.
(5)已知:
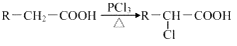
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如图:

分析 A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,根据C的结构可知B是 ,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为
,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为 ;D发生取代反应生成F;
;D发生取代反应生成F;
(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH.
解答 解:A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,根据C的结构可知B是 ,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为
,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为 ;D发生取代反应生成F;
;D发生取代反应生成F;
(1)A为OHC-COOH,A所含官能团名称为:醛基和羧基,故答案为:醛基和羧基;
(2)羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基,故强弱顺序为:③>①>②,
故答案为:③>①>②;
(3)E的结构简式: ,故答案为:
,故答案为: ;
;
(4)D→F的反应类型是取代反应,F中酚羟基、酯基水解生成的羧基、溴原子被取代生成的HBr都能和NaOH反应,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:3mol,
故答案为:取代反应;3;
(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH,合成路线流程图为:CH3COOH$→_{△}^{PCl_{3}}$ClCH2COOH$→_{△}^{NaOH/H_{2}O}$HOCH2COONa$\stackrel{HCl}{→}$HOCH2COOH$→_{△}^{O_{2}/Cu}$OHC-COOH,
故答案为:CH3COOH$→_{△}^{PCl_{3}}$ClCH2COOH$→_{△}^{NaOH/H_{2}O}$HOCH2COONa$\stackrel{HCl}{→}$HOCH2COOH$→_{△}^{O_{2}/Cu}$OHC-COOH.
点评 本题考查有机物的推断与合成,为高考常见题型,侧重考查学生分析推断、知识综合运用及知识迁移能力,明确官能团及其性质关系、物质之间的转化是解本题关键,难点是有机合成路线设计,题目难度中等.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s)=Cu2+(aq)+SO42-(aq) 热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
| A. | 古代金银制品能保存至今是因为它们金属活动性强 | |
| B. | 铜器保存在潮湿的空气中不会生成铜绿 | |
| C. | 铝锅比较耐用,是因为铝锅表面有一层致密的氧化物薄膜 | |
| D. | 不锈钢制成的厨具不易生锈,是因为它不含铁 |
 +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在图1A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(3)本实验中加入过量乙酸的目的是提高醇的转化率.
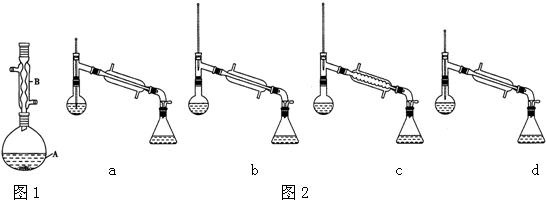
(4)在蒸馏操作中,仪器选择及安装都正确的是b(填标号).
(5)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%