题目内容
5.欲配制物质的量浓度为0.60mol/L的MgCl2溶液450mL,回答下列问题:(1)根据计算,所需的质量为28.5g. 如果某同学称量时将砝码放在左盘,而将药品放在右盘(天平最小砝码为5克),则实际称取质量为21.5 g.
(2)要配制上述溶液,所需仪器除天平、药匙、烧杯、玻璃棒外,还要500mL容量瓶和胶头滴管.
(3)下列操作不会影响所配溶液浓度的是C(填选项代号)
A.定容时加水超过刻度线,用胶头滴管吸出一些 B.转移溶液后,没有洗涤烧杯内壁
C.配制前容量瓶内壁仍残留有蒸馏水 D.定容时仰视
E.转移溶液时部分溶液溅出容量瓶外
(4)在配制好的溶液中取100mL溶液,加入2mol/LNaOH溶液可以制备纯净的Mg(OH)2,计算:恰好完全反应时,需加入NaOH溶液的体积为60mL.
分析 (1)依据配制溶液体积选择容量瓶规格,依据m=CVM计算需要溶质的质量;托盘天平称量原理:左盘的质量=右盘的质量+游码的质量;
(2)依据配制一定物质的量浓度溶液的一般步骤选择仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据Mg2+~2NaOH~Mg(OH)2计算解答.
解答 解:(1)配制物质的量浓度为0.60mol/L的MgCl2溶液450mL,应选择500mL容量瓶,需要溶质的质量m=0.6mol/L×95g/mol×0.5L=28.5g;托盘天平称量原理:左盘的质量=右盘的质量+游码的质量,如果某同学称量时将砝码放在左盘,而将药品放在右盘实际称量的质量为:25g-3.5g=21.5g;
故答案为:28.5;21.5;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、定容、摇匀、装瓶,用到的仪器:天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制物质的量浓度为0.60mol/L的MgCl2溶液450mL,应选择500mL容量瓶,所以还需要的仪器:500mL容量瓶;胶头滴管;
故答案为:500mL容量瓶;胶头滴管;
(3)A.定容时加水超过刻度线,用胶头滴管吸出一些,导致溶质的物质的偏小,溶液浓度偏低,故A不选;
B.转移溶液后,没有洗涤烧杯内壁,导致溶质的物质的偏小,溶液浓度偏低,故B不选;
C.配制前容量瓶内壁仍残留有蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故C选;
D.定容时仰视,导致溶液体积偏大,溶液浓度偏高,故D不选;
E.转移溶液时部分溶液溅出容量瓶外,导致溶质的物质的偏小,溶液浓度偏低,故E不选;
故选:C;
(4)依据Mg2+~2NaOH~Mg(OH)2,设需要氢氧化钠体积为V,则:
Mg2+~2NaOH
1 2
100mL×0.6mol/L V×2mol/L
解得V=60mL;
故答案为:60mL.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用方法,题目难度不大.

| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
| A. | 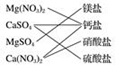 | B. | 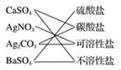 | C. | 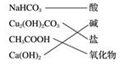 | D. | 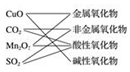 |
| A. | 古代金银制品能保存至今是因为它们金属活动性强 | |
| B. | 铜器保存在潮湿的空气中不会生成铜绿 | |
| C. | 铝锅比较耐用,是因为铝锅表面有一层致密的氧化物薄膜 | |
| D. | 不锈钢制成的厨具不易生锈,是因为它不含铁 |
| A. | 气体摩尔体积就是22.4 L/mol | |
| B. | 1 mol H2的质量只有在标况下才约为2 g | |
| C. | 标况下,18克H2O的体积为22.4 L | |
| D. | H2和O2的混合气体1 mol在标况下的体积约为22.4 L |
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,配成100mL的溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中.
(3)用碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |